|
関西医科大学 総合医療センター 診療部長 教授 宇都宮 啓太 先生 |
|
アイソトープ内部照射療法とは放射性医薬品による核医学治療であり、粒子線放出核種を病巣に集中(ターゲッティング)させて体内から選択的な放射線照射を行うため、内用療法あるいは内部照射療法と呼ばれます。外部照射治療に比べ、低線量率かつ持続照射となるため生物学的効果が異なります。利点はがん病変の部位や個数にかかわらず治療できることです。現在国内で使用されている製剤には以下の種類があります(Table.1)。 Table.1 内用療法の種類
|
| ●131Iについて |
|
131I 甲状腺治療は、非密封治療としてはヨードを体内に投与すると甲状腺組織に取り込まれることを利用してヨウ化ナトリウムカプセルという放射性医薬品を経口投与し、甲状腺病変の組織に取り込ませ、β線で甲状腺癌(特に手術後に肺や骨などに転移した場合に有効)やバセドウ病を治療する方法です。
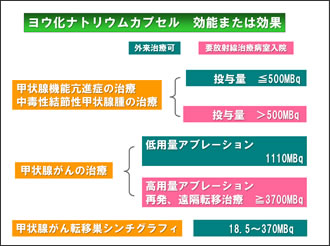
バセドウ病の治療法においては、ATD(抗甲状腺薬)、外科的手術、放射性ヨード内用療法が用いられます。 131Iの使用に関して、バセドウ病の場合は500MBqまでが外来で使用することができ、2010年に出された厚生労働省からの患者の退出基準の通知により1,110MBqの投与であれば外来においてアブレーションを行うことが可能となりました。また、1,110MBqを超える場合は遮蔽された放射線治療病室を使用することで可能となります(Fig.2)。
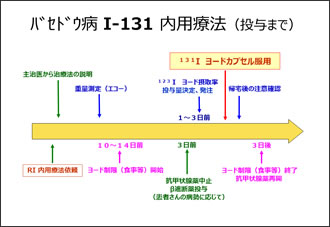
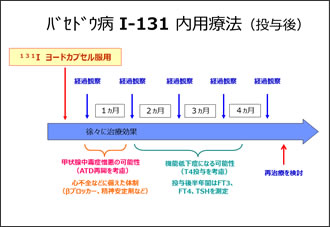
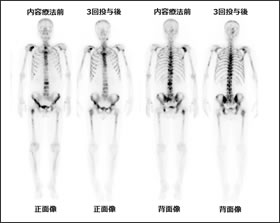
当施設でのバセドウ病の治療の流れを紹介します(Fig.3)(Fig.4)。
投与量の決定については様々な報告があります。
当施設における投与量の決定方法と、甲状腺1g当りの投与量を示します(Fig.5)(Fig.6)。
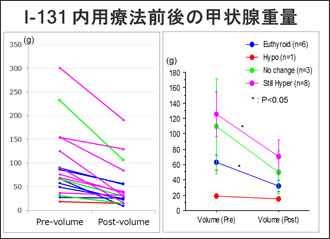
実際のバセドウ病の内用療法前後の画像例を示します(Fig.7)。 個人差はありますが、治療を行うことでサイズが2/3~1/2程度にまで縮小するケースもあります。当院での治療前後での甲状腺重量を比較した結果ですが、治療前のサイズが大きい症例では治療後に縮小していることが確認できます(Fig.8)。
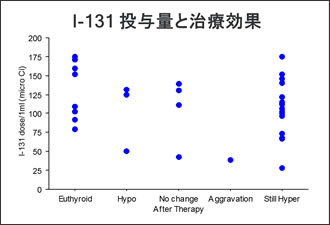
投与量と治療効果の関係を示します(Fig.9)。EuthyroidからStill Hyperまで様々な治療結果に対して投与量との相関は得られませんでした。Fig5. -3)のように甲状腺重量、有効半減期から投与量を決定する方法を用いることで投与量の最適化が図れる可能性はありますが、有効半減期を求める為にはサンプリングを細かく得る必要があり、困難であるというのが現状です。
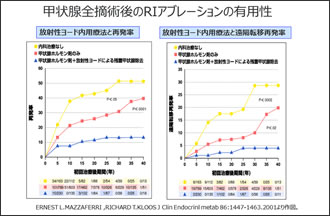
次に甲状腺がんに対するアブレーションですが、甲状腺がんは全摘をした後にも皮下に悪性細胞が残存することも多く、アブレーションを併用して治療することで細胞レベルに転移があったところを治療できることで、再発率および遠隔転移再発率が低下すると考えられています(Fig.10)。
外来でのアブレーションの適応(2010年 甲状腺腫瘍診断ガイドライン)を示します(Fig.11)(Fig.12)。
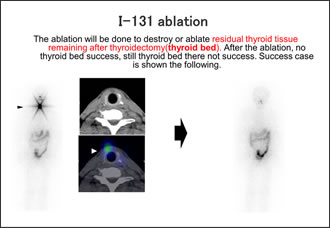
実際のアブレーションの成功例を示します。CTだけでは指摘できない領域へ集積していることが確認でき、治療後に明らかに集積が低下していることが認められた症例です(Fig.13)。
|
| ●131I-MIBGについて |
|
MIBGは、ノルエピネフリンと同じ機序でアミン摂取機構により交感神経髄質組織の細胞膜を通過し、細胞内のカテコールアミン貯蔵顆粒に輸送されます。その為カテコールアミンを多く産生する腫瘍、褐色細胞腫、甲状腺髄様癌、神経芽細胞腫などに対してβ線で治療することができます。投与量としては少なくとも3.7GBq、場合によっては7.4GBq以上を投与する必要があります。日本では保険適応ではありません。
|
| ●90Yについて |
|
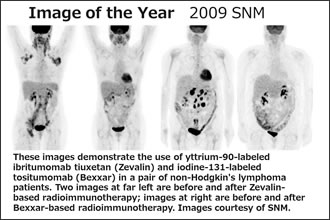
内用療法はどのように腫瘍細胞へ治療薬を集積させるかが重要です。ゼヴァリンはCD20抗原に対する抗体(イブリツモマブ)に90Yをキレート剤で繋いだ薬剤です。2009年のSNM Image of the Yearでは、この90Yの画像が選ばれました(Fig.14)。
|
| ●223Raと89Srについて |
|
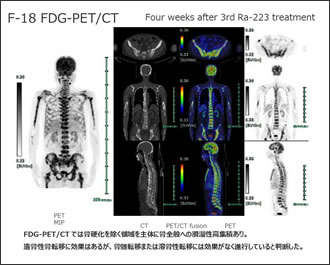
Sr, Ra はCaの同族体(2価アルカリ土類金属)である為(Fig.15)、一般的には骨転移部位(周辺)での造骨活性によるコラーゲンの合成とミネラル化に依存して集積します。(骨シンチグラフィの陽性部位と同部位) 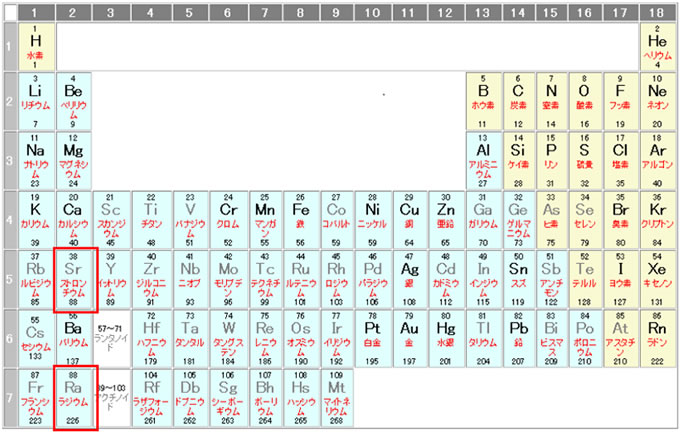 Fig.15 元素周期表
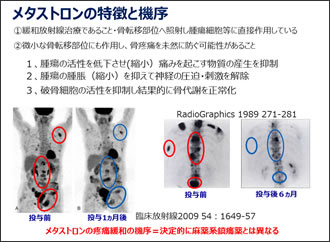
89Srメタストロンは89Srから放出されるβ線とビスホスホン酸との併用で抗腫瘍効果があるという報告もありますが(Fig.16)、 保険適応は疼痛緩和のみになります。
抗腫瘍効果に対して保険適応されているのが2016年3月に承認された223Ra(ゾーフィゴ)です。
|
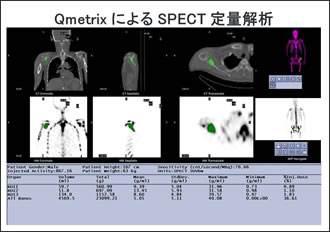
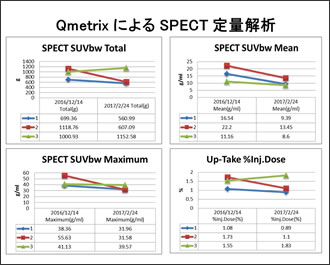
| ●Q.Metrixについて |