1.超高齢社会での疾病発生環境とは
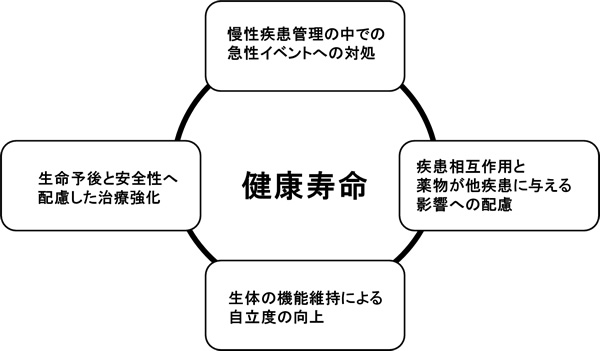
超高齢社会が進行することで私たちの社会の疾病構造は大きく変化している。
第1に超高齢に至ると言うことは、人生の中途で遭遇する急性疾患で死亡する確率が低下しているということである。その結果、若年者に比べ回復能力が低下した超高齢者でイベントが発生することになる。すると、平均余命の短くなった超高齢者で、どこまでイベントに対応することが人生の幸福か?と言う社会的問題も生じてくる。後者は、安楽死あるいは緩和ケアといった生命の価値判断にまで踏み込む哲学的な命題である。
第2は、基礎疾患となる慢性疾患を抱える高齢者が増加するということである。このことは、併存疾患同士の影響、ならびに各々の疾患への治療薬が他の疾患に及ぼす影響について考えなければならないという、医療従事者にとって極めて現実的な問題を提起する。
第3は、今までは生きている間に発生することが稀であった臨床的イベントが、我々の人生に現実的な問題として突きつけられてきたと言うことである。初老期うつ・認知症などの増加はその典型的な例である。筋骨格系においては、自力で動けなくなった「動物」であるヒトの生命が、本人が望むと望まざるとに関わらず維持される状態が発生する。いわゆる「寝たきり・要介護」である。
図1 超高齢社会における疾病構造の変化
2.生活習慣病と骨粗鬆症
生活習慣病も骨粗鬆症も共に加齢に伴い増加する疾患であるが、両者が併存することに意味があるとすれば、一方の疾患が他方の疾患の発症・進展に影響を与える場合と、薬剤選択に影響を及ぼす場合とである。生活習慣病の中で糖尿病は、骨質劣化型の骨粗鬆症を来す疾患の代表的なものである1)。また最近では、μCTを用いた解析により皮質骨の多孔性の増加による構造的脆弱性を糖尿病が促進する事も報告されている2)。では、糖尿病患者全員が同じように骨粗鬆症骨折の高リスク患者なのであろうか?答はもちろん「否」である。糖尿病患者の中で、骨折高リスクの者を抽出する場合には、やはりAGEの蓄積という側面から考えるとわかりやすい。今まで得られた臨床データでは、病歴の長い患者、合併症の多い患者、HbA1c値が高値(2015年版のガイドラインの提唱は7.5%以上)が続く者は、骨折リスクが高い3)。これらの患者は、骨内にもAGEが蓄積していることが想像しやすい。さらに、網膜症による視力障害、神経障害による易転倒性、腎症によるミネラル骨代謝異常は、さらに骨折リスクを高めることが明らかである。
3.骨粗鬆症の診断に及ぼす糖尿病の影響
残念ながら現状で、糖尿病患者に特化した骨粗鬆症診断基準は決められていない。上記のμCTを用いた皮質骨多孔性の増加はfinite element analysis (FEA)による解析でも、確かに骨脆弱性と関連しているが日常臨床で用いることは難しい。最近、DXA法にて測定された腰椎正面画像をピクセル分析することで、微細構造をある程度把握するソフトウエアTrabecular Bose Score (TBS)法が臨床の現場で使用可能となってきた(保険未収載)4)。糖尿病患者においてTBS法によりDXA法では診断できなかった骨折高リスク患者を抽出できる可能性が報告されている5)。
骨代謝回転については、AGEの蓄積が骨形成低下に結びつくことと、AGE架橋成分となるペントシジンに関する検討が報告されている6)(図2)。
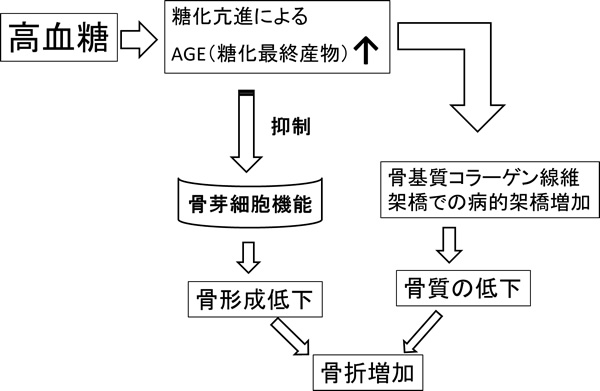 図2 高血糖による骨質劣化の機序
図2 高血糖による骨質劣化の機序
尿中ペントシジン排泄は糖尿病患者での骨へのAGEの蓄積をある程度反映していると考えられておりいわゆる骨質マーカーととらえられており、ある程度リスク評価に用いることができるが、糖代謝の改善そのものがペントシジンの蓄積に直接反映されるかいなかについては明らかとはされていない。最近測定可能となった骨形成阻害因子スクレロスチンは、血中濃度が糖尿病患者で上昇していることが報告されており7)、抗スクレロスチン抗体が臨床治験第三相にすすんでいることもあって注目を浴びている8)。
臨床的な骨折危険因子を統合して、骨折リスクを評価するツールが開発されているが、その中で最も有名なものがFRAX(WHO Fracture Risk Assessment Tool)である。FRAXの中には続発性骨粗鬆症をチェックする項目があるが、この項目で含まれるのは1型糖尿病であり、2型糖尿病はリスク評価する対象に挙げられていない。まして、2型糖尿病の中の病態・病勢におけるリスクの層別化は全くなされていない。その中で、2型糖尿病患者を対象として、実際の骨折発生率とFRAXのデータを比較した研究によると、FRAXによる骨折リスク評価は、2型糖尿病患者の骨折リスクを過小評価することが示されている9)。最近FRAXにTBSのデータを外挿してリスクの精度を高める工夫がされているが、2型糖尿病患者でこそ、これらの評価方法は有効かもしれない。
4.骨粗鬆症治療薬と糖尿病治療薬とが相互の疾患に与える影響
骨粗鬆症治療薬の中で、特に骨吸収抑制薬が糖代謝に影響を与える可能性が考えられた。その理由は、骨で産生されたオステオカルシンがインスリン分泌を助けるというKarsentyらの学説に基づくものである10)。ビスホスホネート薬の投与によりオステオカルシンならびに低カルボキシル化オステオカルシンの血中濃度が低下することが示されているが11,12)、その一方、ビスホスホネート薬(アレンドロネート)を投与されている患者では新規糖尿病発生率はむしろ低下するというデータも示されている13)。またFIT(Fracture intervention trial)研究で行われた全身DXA法のデータでは、骨量と同時に軟部組織、脂肪量、除脂肪軟部組織量が測定されているが、いずれもアレンドロネート群とプラセボ群で差がなく、ビスホスホネート薬でインスリン抵抗性が増加するとも考えられなかった14)。新規糖尿病発症率については、アレンドロネート、ゾレドロン酸、デノスマブのいずれも上昇させなかった。以上を考えると、少なくとも骨粗鬆症の治療により糖尿病が発症・進展することはなさそうである。
逆に臨床的影響が考えられているのは、糖尿病治療薬の骨代謝への影響である(表1)。
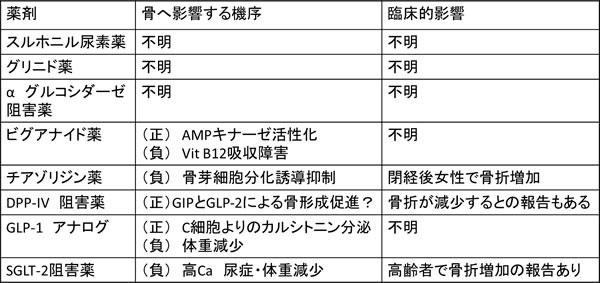 表1 抗糖尿病薬は骨代謝に影響を与えるか
表1 抗糖尿病薬は骨代謝に影響を与えるか
骨折増加のデータが明確に示されているのはチアゾリジン薬で、特に閉経後女性で既発骨折のあるものにその傾向が強い15)。逆に骨折抑制効果が期待されているものが、DPP4阻害薬であるが、臨床的に有効な骨折予防効果があるかどうかについては、結論が出ていない16,17)。最近わが国でも使用可能となったSGLT-2阻害薬は、尿糖排泄ともに高カルシウム尿症を惹起して骨代謝に対して負の影響をあたえることと長期間投与でサルコペニアを生じる事が懸念される。現在までの短期間の検討では、骨量ならびに骨折発生に対して大きな影響は与えないという報告と一部骨密度低下につながるという報告とが認められている18-21)。経口薬よりもより顕著に骨折発生と結びつくのが、インスリンによる治療である。インスリン使用者は、同一の骨密度であっても骨折リスクが上昇することも報告されている22)。ただし、インスリンそのものが骨代謝に著しい負の影響を与えるわけではなく、膵機能が低下しインスリン分泌が減少した状態)が、骨折リスクとなると考えられている。
5.日常診療にどのように骨粗鬆症診療を組み入れるか?
生活習慣病を有する患者に対して、骨粗鬆症の治療を行うことには、診療上有利な点と不利な点とがある。有利な点は、継続的な通院加療を行うことが併存疾患のため容易であることで、骨粗鬆症診療において大きな問題となっている治療からの脱落の可能性が低くなることが期待される。また、診療医と患者との間に良好な人間関係が構築されているため、「骨折予防」という効果の見えにくい治療に対しての信頼もえられやすい。不利な点は、すでに他疾患のために治療が行われているため、骨粗鬆症の治療が加わる事への抵抗感や負担感をもたれがちなことである。また、主治医としても、サロゲートマーカーによる治療目標が明示しやすい生活習慣病の診療に追われ、骨粗鬆症についての診療の優先順位が下がりがちになることは否めない。では、この不利な点を、日常臨床の中でどのように処理すれば良いであろうか?
最も大切なことは、スクリーニングのポイント、治療開始の基準、期待される効果ならびに治療見直しのスケジュールについて、最初の時点で患者に明示することと考える(表2)。
 表2 日常診療に組み入れる骨粗鬆症診療のポイント(筆者作成)
表2 日常診療に組み入れる骨粗鬆症診療のポイント(筆者作成)
スクリーニングをすべきかどうかは、主として骨折の臨床的危険因子を勘案して決定する。骨粗鬆症性骨折の最大の危険因子(骨餅度は除く)は、年齢、骨折歴、家族歴であるため、まずある年齢に達したら、ひとまず骨粗鬆症のスクリーニングをかけるべきと考えられる。形態学的椎体骨折も含めると、遅くとも70才の時点では骨粗鬆症のスクリーニングを行った方が良いと思われるが、生活習慣病そのものも、骨粗鬆症の増悪因子となることから、65才では骨検診受診勧奨を含め、なんらかの骨の健康への注意喚起が望ましい。両親の大腿骨近位部骨折の家族歴も、大きなリスク因子となるため、これらの家族歴を有する患者に対しては、さらに早い時期からのスクリーニングが臨まれる。もちろん、脆弱性骨折発生時に、診断と治療介入を行うべき事はいうまでもない。患者のモチベーションを保つためには、具体的な証拠が必要である。短期(治療開始3-6か月)においては骨代謝マーカーによる確認が有効であり、長期(2-5年)においては骨密度による確認が有用である。ただし、骨密度上昇は使用される薬剤によっては、服薬継続の決定要因とならないことにも留意すべきである。一般に骨粗鬆症治療薬は、10年間の骨折リスクの低減をはかることが基準となっているので、単一の薬剤を開始して、10年後には、少なくとも薬剤選択についての再評価は必要である。
治療のチェックポイントのスケジュールを、診療する側とされる側とが共有することで、日常診療にスムーズに骨粗鬆症診療を取り入れやすくなることが期待される。
おわりに
糖代謝異常は心血管イベントの発生率を高め、発がんリスクも高めるが、筋骨格系への悪影響も明らかになってきた。逆に骨カルシウム代謝異常の是正は、動脈硬化の改善につながる可能性もあり、健康寿命の延伸のためには両疾患群を俯瞰した疾病管理が肝要である。
【文献】
1. Schwartz AV. Diabetes mellitus: does it affect bone? Calcif Tissue Int. 2003; 73: 515-519.
2. Patsch JM, Burghardt AJ, Yap SP, et al. Increased cortical porosity in type 2 diabetic postmenopausal women with fragility fractures. J Bone Miner Res. 2013; 28: 313-324.
3. 骨粗鬆症の予防と治療ガイドライン作成委員会. 第IV章続発性骨粗鬆症. B.疾患関連骨粗鬆症. b生活習慣病関連骨粗鬆症. (1) 糖尿病. In: 折茂肇ら(編). 骨粗鬆症の予防と治療のガイドライン2015年版. 東京:ライフサイエンス出版;2015. P130-131.
4. Hans D, Goertzen AL, Krieg MA, et al. Bone microarchitecture assessed by TBS predicts osteoporotic fractures independent of bone density: the Manitoba study. J Bone Miner Res. 2011; 26: 2762-2769.
5. Kim JH, Choi HJ, Ku EJ, et al. Trabecular bone score as an indicator for skeletal deterioration in diabetes. J Clin Endocrinol Metab. 2015; 100: 475-482.
6. Saito M, Marumo K. Effects of Collagen Crosslinking on Bone Material Properties in Health and Disease. Calcif Tissue Int. 2015; 97: 242-261.
7. Moester MJ, Papapoulos SE, Löwik CW et al. Sclerostin: current knowledge and future perspectives. Calcif Tissue Int. 2010; 87: 99-107.
8. McClung MR, Grauer A, Boonen S, et al. Romosozumab in postmenopausal women with low bone mineral density. N Engl J Med. 2014; 370: 412-420.
9. Schwartz AV, Vittinghoff E, Bauer DC et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. JAMA 305: 2184-2192, 2011
10. Karsenty G, Ferron M. The contribution of bone to whole-organism physiology. Nature. 2012; 481: 314-320.
11. Johnell O, Scheele WH, Lu Y et al: Additive effects of raloxifene and alendronate on bone density and biochemical markers of bone remodeling in postmenopausal women with osteoporosis. J Clin Endocrinol Metab 87: 985-992, 2002.
12. Schafer AL, Sellmeyer DE, Schwartz AV, et al: Change in undercarboxylated osteocalcin is associated with changes in body weight, fat mass, and adiponectin: parathyroid hormone (1-84) or alendronate therapy in postmenopausal women with osteoporosis (the PaTH study). J Clin Endocrinol Metab. 96: E1982-1989, 2011.
13. Vestergaard P. Risk of newly diagnosed type 2 diabetes is reduced in users of alendronate. Calcif Tissue Int. 89: 265-270, 2011.
14. Schwartz AV, Schafer AL, Grey A, et al: Effects of antiresorptive therapies on glucose metabolism: results from the FIT, HORIZON-PFT, and FREEDOM trials. J Bone Miner Res. 28: 1348-1354, 2014.
15. McDonough AK, Rosenthal RS, Cao X, et al. The effect of thiazolidinediones on BMD and osteoporosis. Nat Clin Pract Endocrinol Metab. 2008; 4: 507-13
16. Monami M, Dicembrini I, Antenore A, et al. Dipeptidyl peptidase-4 inhibitors and bone fractures: a meta-analysis of randomized clinical trials. Diabetes Care. 2011 ; 34: 2474-2476.
17. Driessen JH, van Onzenoort HA, Starup-Linde J, et al. Use of dipeptidyl peptidase 4 inhibitors and fracture risk compared to use of other anti-hyperglycemic drugs. Pharmacoepidemiol Drug Saf. 2015 Jul 16. doi: 10.1002/pds.3837.
18. Ljunggren Ö, Bolinder J, Johansson L, et al. Dapagliflozin has no effect on markers of bone formation and resorption or bone mineral density in patients with inadequately controlled type 2 diabetes mellitus on metformin. Diabetes Obes Metab. 2012; 14: 990-9.
19. Bolinder J, Ljunggren O, Johansson L, et al., Dapagliflozin maintains glycaemic control while reducing weight and body fat mass over 2 years in patients with type 2 diabetes mellitus inadequately controlled on metformin. Diabetes Obes Metab. 2014 ; 16: 159-169.
20. Watts NB, Bilezikian JP, Usiskin K, et al. Effect of canagliflozin on fracture risk in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab in press
21. Bilezikian JP, Watts NB, Usiskin K, et al. Evaluation of bone mineral density and bone biomarkers in patients with type 2 diabetes treated with canagliflozin. J Clin Endocrinol Metab in press
22. Schwartz AV, Vittinghoff E, Bauer DC, et al. Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. JAMA. 2011; 305: 2184-2192.