はじめに
生活習慣病と骨粗鬆症はいずれも加齢に伴い増加することから、併存する場合が多い。しかし、両者は単に併存するだけでなく、2型糖尿病(diabetes mellitus: DM)や慢性腎臓病(chronic kidney disease: CKD)といった生活習慣病が骨代謝に大きな影響をおよぼすことが明らかとなってきている。これまでに蓄積されたエビデンスをもとに、生活習慣病の骨折リスクの評価や管理等について概説した「生活習慣病骨折リスクに関する診療ガイド」が日本骨粗鬆症学会より刊行されている1)。現在、生活習慣病関連骨粗鬆症として確立されている原因疾患は、コントロール不良のDMとステージG3以上のCKDであり、「骨粗鬆症の予防と治療ガイドライン」でも生活習慣病関連骨粗鬆症は続発性骨粗鬆症の代表例と位置づけられている2)。
生活習慣病関連骨粗鬆症をきたす疾患
1. 2型糖尿病
1型DMが明らかな骨折の危険因子であることは古くから知られており、続発性骨粗鬆症をきたす疾患として挙げられていた。一方、2型DMが骨折リスクを高めるか否かについては明らかになっていなかった。しかし、2007年に2型DMについても大腿骨近位部骨折の有意な危険因子となることがメタ解析にて示された(表1)3)。筆者らも欧米人に比し日本人に多い椎体骨折について横断検討を行い、2型DMは年齢、BMI、腰椎骨密度とは独立した既存椎体骨折の危険因子であることを報告した4)。 そしてメタ解析においてもう一つ明らかにされたことは、2型DM群では性、年齢を一致させた対照群に比し、腰椎、大腿骨骨密度は有意に高いということである(表1)3)。
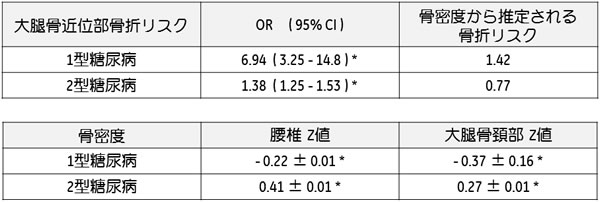 表1.糖尿病における骨密度と大腿骨近位部骨折リスク1型DMでは性、年齢を一致させた群に比し、骨密度が有意に低く、2型DMでは有意に高いことがメタ解析により示された。1型DMの骨密度Z値から推定される大腿骨近位部骨折リスクは1.42倍であるが、実際の骨折リスクは6.94倍であった。2型DMにおける推定値は0.77倍であったが、実際の骨折リスクは1.38倍と増加していた。*:2p<0.05文献3より引用改変
表1.糖尿病における骨密度と大腿骨近位部骨折リスク1型DMでは性、年齢を一致させた群に比し、骨密度が有意に低く、2型DMでは有意に高いことがメタ解析により示された。1型DMの骨密度Z値から推定される大腿骨近位部骨折リスクは1.42倍であるが、実際の骨折リスクは6.94倍であった。2型DMにおける推定値は0.77倍であったが、実際の骨折リスクは1.38倍と増加していた。*:2p<0.05文献3より引用改変
つまり、2型DMでは骨密度が高いにも関わらず骨折リスクが高まる。筆者らの横断検討でも、2型DM群はいずれの部位の骨密度も対照群に比し高値を示し(図1)、DM群における骨折リスク評価因子として骨密度は有用ではなかった4)。
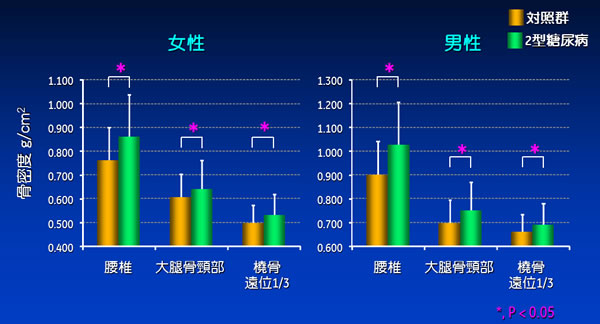 図1. 対照群と2型DM群における骨密度の比較性別にかかわらず、2型DM群はいずれの部位の骨密度も対照群に比し高値を示した。文献4より引用改変
図1. 対照群と2型DM群における骨密度の比較性別にかかわらず、2型DM群はいずれの部位の骨密度も対照群に比し高値を示した。文献4より引用改変
さらに、前向き試験において同じ骨密度であれば2型DM群の方が非DM群に比し骨折リスクは高いことが示されている(図2)5)。
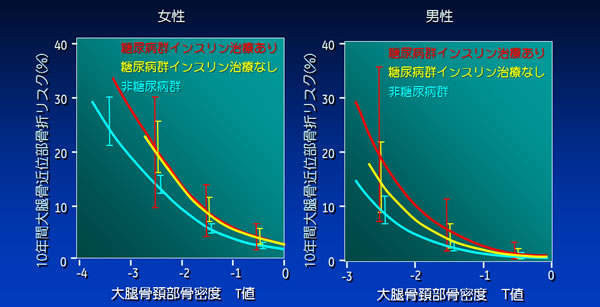 図2. 大腿骨頚部骨密度Tスコアと10年間の累積大腿骨近位部骨折率高齢者を対象とした縦断検討において、対照群と同じ骨密度の場合、2型DM群では、
図2. 大腿骨頚部骨密度Tスコアと10年間の累積大腿骨近位部骨折率高齢者を対象とした縦断検討において、対照群と同じ骨密度の場合、2型DM群では、性別、インスリンの使用状況にかかわらず、大腿骨近位部骨折リスクが高い。
ただし、非DM群と同様に2型DM群においても骨密度が低下するほど骨折リスクは上昇する。
文献5より引用改変
つまり、2型DMではステロイド性骨粗鬆症のように、骨密度で想定される以上の骨脆弱化が存在する。この要因として、2型DMでは転倒リスクが高いため、この関与が考えられるが、転倒頻度で補正後も骨折リスクが高いとの報告が多い。このことから、2型DMでは骨密度以外で骨強度の低下に関わる因子、つまり骨質の劣化が存在する。
DMにおける骨質劣化の要因のひとつに、コラーゲンの質の低下がかかわる6)。コラーゲンはリジルオキシダーゼにより、遺伝的に決定された部位の分子間に生理的架橋が形成されるが、DMではこの生理的架橋が低形成となる。また、コラーゲンは時間依存的かつ、酵素非依存的にAGEs(advanced glycation end products: 終末糖化産物)架橋を形成する。持続的高血糖や酸化ストレスが高まった状態ではAGEs架橋が増加し骨強度の低下を招く。代表的なAGEsのひとつであるペントシジンは、臨床検討において血中や尿中ペントシジン高値がDMにおける骨折リスク因子であると報告されている。
DMは構造特性にも影響をおよぼす。high-resolution peripheral quantitative computed tomography (HR-pQCT)による検討で、対照群に比しDM群では皮質骨が多孔化しており、骨折群ではさらに多孔化していることが報告されている7)。一方、海綿骨についてもDM群では海綿骨微細構造指標が対照群に比し有意に低いとされる。このように皮質骨、海綿骨の構造的強度の低下もDMにおける骨質劣化にかかわる。
どの程度の重症度のDMが骨折リスクに関わるかについては、コホート研究においてHbA1c 7.5%以上の群は非DM群に比して骨折リスクが有意に高いことや8)、HbA1cが高くなるにつれ骨折リスクが高まることが報告されており、コントロール不良の2型DM群において骨折リスクが高まる。
2. 慢性腎臓病
重度のCKDが骨粗鬆症をきたすことはよく知られているが、CKDステージG3[推定糸球体濾過量; estimated glomerular filtration rate (eGFR) 30-59mL/min/1.73m2]の腎障害でも骨折リスクが高まるとの報告が集積されてきている。40歳以上の67万人を対象とした前向きコホート研究でも、女性、および65歳を超える男性ではCKDステージG3a(eGFR 45-59)から骨粗鬆症性骨折リスクが有意に高まることが報告された(表2)9)。
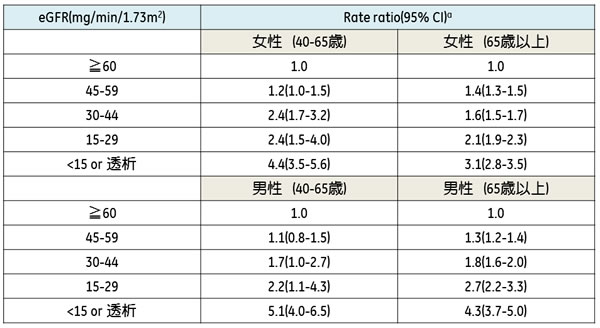 表2. 3年間の前向き研究における性、年齢、腎機能別の骨粗鬆症性骨折発生率40歳以上の67万人を対象とした3年間の前向きコホート研究において、女性、および65歳を超える男性ではCKDステージG3a(45-59)から、40~65歳男性ではCKDステージG3b(30-44)から骨粗鬆症性骨折(大腿骨近位部、前腕、骨盤、上腕骨)リスクが有意に高まる。CI: confidence interval, eGFR: estimated glomerular filtration ratea: eGFR ≧60ml/min/1.73m2群をreferent groupとして算出文献9より引用改変
表2. 3年間の前向き研究における性、年齢、腎機能別の骨粗鬆症性骨折発生率40歳以上の67万人を対象とした3年間の前向きコホート研究において、女性、および65歳を超える男性ではCKDステージG3a(45-59)から、40~65歳男性ではCKDステージG3b(30-44)から骨粗鬆症性骨折(大腿骨近位部、前腕、骨盤、上腕骨)リスクが有意に高まる。CI: confidence interval, eGFR: estimated glomerular filtration ratea: eGFR ≧60ml/min/1.73m2群をreferent groupとして算出文献9より引用改変
軽度から中等度のCKDにおける骨脆弱性の機序の詳細は不明であるが、腎障害の早期からペントシジンや高感度CRP、骨質劣化に関わるホモシステインが上昇するとされ、これらの関与が推定されている。構造特性への影響については、高齢者を対象としたHR-pQCTでの検討においてCKDステージG2やG3レベルですでに海綿骨微細構造の劣化を認めるとの報告がある10)。
また、腎機能低下に伴い転倒リスクも高くなることから、転倒の関与も示唆されている。
3. 慢性閉塞性肺疾患
慢性閉塞性肺疾患(chronic obstructive pulmonary disease:COPD)は、喫煙などの有害物質の長期間吸入曝露により生じる肺の炎症性疾患である。
横断検討において、呼吸機能検査の1秒率が低下している群ほど大腿骨骨密度T-scoreが-2.5SD以下の例の割合が高いとされる。本邦におけるCOPD男性を対象とした横断検討でも、COPD重症度が高いほど、腰椎、大腿骨の骨密度Z-scoreが低いことが報告されている11)。
COPDの骨折への影響については、システマティックレビューによると、X線によるCOPDの椎体骨折有病率は24~63%であり、胸椎骨折が多く、男性でもリスクが増大する12)。日本人のCOPD男性を対象とした横断検討によると、X線検査で判定した椎体骨折有病率は79.4%と極めて高く、椎体骨折数と1秒率に有意な負相関を認めるとされる11)。COPDは生活習慣病関連骨粗鬆症のひとつとしての認識が高まってきている。
COPDにおける骨粗鬆症には、COPDの重症度、低体重、サルコペニア、慢性炎症、低酸素血症、喫煙、全身性ステロイド薬投与、ビタミンD不足などがかかわるとされる。
椎体骨折による円背は胸郭運動を障害し、呼吸機能をさらに低下させるため、COPD患者では性別を問わず早期の骨粗鬆症評価が望まれる。
生活習慣病関連骨粗鬆症の管理
生活習慣病と骨粗鬆症は、酸化ストレス、AGEsなどその病因・病態に共通性を有するため、生活習慣病自体の是正による骨粗鬆症の改善効果も期待される。しかし、これのみで骨折リスクを早期に低減できるとは考えにくく、骨粗鬆症薬物治療が必要である。
生活習慣病関連骨粗鬆症の管理については未だ確立されておらず、現時点では原発性骨粗鬆症の薬物治療開始基準に準じる2)。「骨粗鬆症の予防と治療ガイドライン」では骨折リスク評価ツール(FRAX®)が採用されているが2)、2型DMにおける骨脆弱性はFRAX®では過小評価となる5)。このことから、「骨粗鬆症の予防と治療ガイドライン2015年版」2)では、「生活習慣病骨折リスクに関する診療ガイド」1)とほぼ同様ながら、HbA1c値について明確化した2型DMにおける薬物治療開始基準の試案が示されている。つまり、脆弱性骨折がない場合には、罹病歴が長く、HbA1cが7.5%以上と高値で、インスリンを必要とするようなDMの存在を、骨密度が骨粗鬆症域となる前[young adult mean(YAM)の80%未満]での薬物治療開始の判断材料とすることが提案されている(図3)2)。
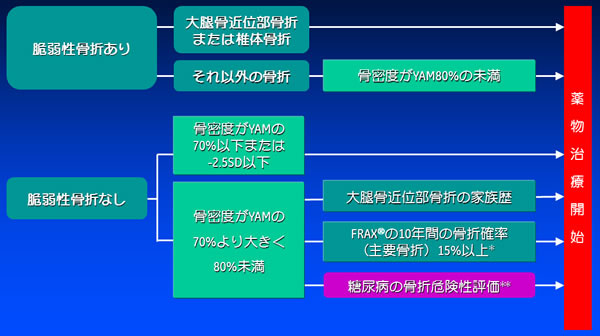 図3. 2型糖尿病の骨折リスクに対する薬物療法(薬物治療開始基準試案)YAM : young adult meanFRAX® : fracture risk assessment tool* : 75歳未満で適用** : 罹病歴が長い、HbA1c 7.5%以上、インスリン治療中の糖尿病では骨折リスクが高いなど文献2より引用
図3. 2型糖尿病の骨折リスクに対する薬物療法(薬物治療開始基準試案)YAM : young adult meanFRAX® : fracture risk assessment tool* : 75歳未満で適用** : 罹病歴が長い、HbA1c 7.5%以上、インスリン治療中の糖尿病では骨折リスクが高いなど文献2より引用
いずれにしても、生活習慣病関連骨粗鬆症では原発性骨粗鬆症に準じた評価では骨折リスクを過小評価している可能性が高く、少なくとも原発性骨粗鬆症薬物治療開始対象者には遅滞なく治療を開始するべきである。原発性骨粗鬆症の診断基準(2012年度改訂版)では、脆弱性骨折が椎体、あるいは大腿骨近位部に認められた場合は骨密度に関係なく骨粗鬆症と診断される13)。脆弱性骨折の存在は骨密度とは独立した骨折リスク因子であり、骨質も含めた骨強度の評価法といえる。生活習慣病を有する例ではことさら脆弱性骨折の有無の問診が重要である。また、椎体骨折は非椎体骨折と異なり、2/3以上が無症状であるため、問診では聴取できず胸椎・腰椎X線検査による骨折の判定が必要である。特に問診で3cm以上の身長短縮がある例では形態椎体骨折を有する可能性が高いため、X線検査による確認が不可欠である。
2型DMでは骨密度で想定される以上に骨脆弱化が存在するが、2型DMにおいても骨密度が低下すると骨折リスクは高まることは非DMと同様である(図2)。さらに、縦断検討において骨密度の低下率は非DM群に比し2型DM群で有意に大きいことが報告されていることから14)、2型DMにおいても骨密度測定は必須である。
おわりに
骨折を一度きたすとADLが損なわれ、その結果として生活習慣病の病態も悪化するという悪循環をまねく。よって、生活習慣病患者においては骨粗鬆症治療による骨折防止が特に重要である。コントロール不良の2型DMやステージG3のCKD、COPDを有する例では、性別を問わずX線による椎体骨折判定や骨密度測定など、積極的な骨粗鬆症の評価が推奨される。
【引用文献】
1) 日本骨粗鬆症学会生活習慣病における骨折リスク評価委員会: 生活習慣病骨折リスクに関する診療ガイド, ライフサイエンス出版, 2011.
2) 骨粗鬆症の予防と治療ガイドライン作成委員会: 骨粗鬆症の予防と治療ガイドライン2015年版, ライフサイエンス出版, 2015.
3) Vestergaard P: Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes-a meta-analysis. Osteoporos Int 18: 427-444, 2007.
4) Yamamoto M, Yamaguchi T, Yamauchi M, et al: Diabetic patients have an increased risk of vertebral fractures independent of BMD or diabetic complications. J Bone Miner Res 24: 702-709, 2009.
5) Schwartz AV, Vittinghoff E, Bauer DC, et al: Association of BMD and FRAX score with risk of fracture in older adults with type 2 diabetes. JAMA 305: 2184-2192, 2011.
6) Saito M and Marumo K: Collagen cross-links as a determinant of bone quality: a possible explanation for bone fragility in aging, osteoporosis, and diabetes mellitus. Osteoporos Int 21: 195-214, 2010.
7) Patsch JM, Burghardt AJ, Yap SP, et al: Increased cortical porosity in type 2 diabetic postmenopausal women with fragility fractures. J Bone Miner Res 28: 313-324, 2013.
8) Oei L, Zillikens MC, Dehghan A, et al: High bone mineral density and fracture risk in type 2 diabetes as skeletal complications of inadequate glucose control: the Rotterdam Study. Diabetes Care 36: 1619-1628, 2013.
9) Naylor KL, McArthur E, Leslie WD, et al: The three-year incidence of fracture in chronic kidney disease. Kidney Int 86: 810-818, 2014.
10) Bacchetta J, Boutroy S, Vilayphiou N, et al: Early impairment of trabecular microarchitecture assessed with HR-pQCT in patients with stage II-IV chronic kidney disease. J Bone Miner Res 25: 849-857, 2010.
11) Watanabe R, Tanaka T, Aita K, et al: Osteoporosis is highly prevalent in Japanese males with chronic obstructive pulmonary disease and is associated with deteriorated pulmonary function. J Bone Miner Metab 33: 392-400, 2015.
12) Lehouck A, Boonen S, Decramer M, et al: COPD, bone metabolism, and osteoporosis. Chest 139: 648-657, 2011.
13) 日本骨代謝学会、日本骨粗鬆症学会合同原発性骨粗鬆症診断基準検討委員会: 原発性骨粗鬆症の診断基準(2012年度改訂版). Osteoporosis Japan 21: 9-21, 2013.
14) Schwartz AV, Ewing SK, Porzig AM, et al: Diabetes and change in bone mineral density at the hip, calcaneus, spine, and radius in older women. Front Endocrinol 4: 62, 2013.