長年、GEのDXA装置(骨密度測定装置)をお使いいただいている和歌山県立医科大学 腎臓内科学講座 教授 重松 隆 先生から「慢性腎臓病(CKD)における骨と血管」についてご執筆いただきました。
I.はじめに
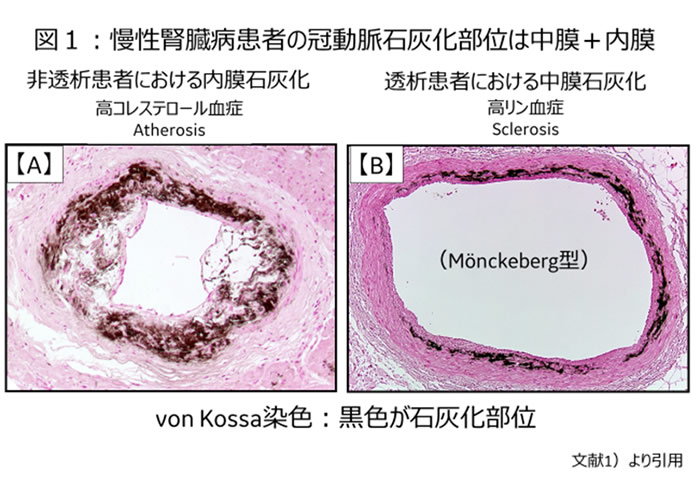
血管は加齢などにより石灰化が進むことが知られている。血管石灰化は動脈硬化症(Atherosclerosis)の一症候であるが、大きく分けると2種に分類される。すなわち血管内膜の石灰化と中膜の石灰化である。
前者の血管内膜石灰化はAtherosisとも言うべき病態で、高LDL−C血症や低HDL−C血症のような脂質代謝異常と大きな関連性があることはよく知られている【図1-A】1)。
後者はSclerosisとも言うべき病態で、カルシウム(Ca)やリン代謝・ひいては骨代謝と関連していることが明らかになって来ている【図1-B】1)。
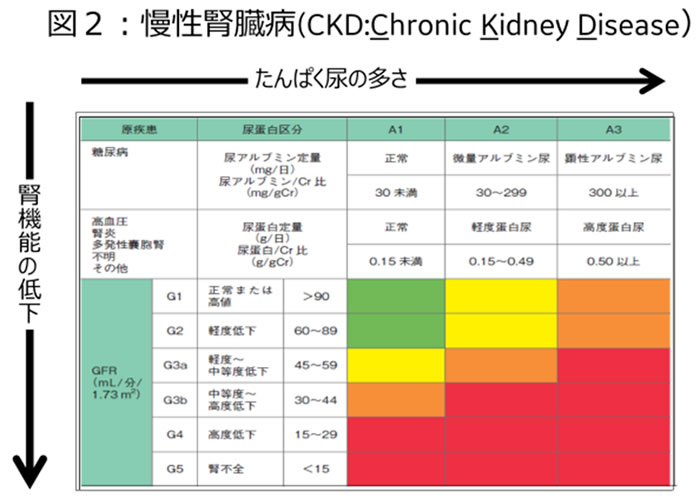
特に後者の血管中膜の石灰化は腎機能障害者である慢性腎臓病(CKD : Chronic Kidney Disease)患者【図2】で
顕著に認められる。
このCKD患者は全く自覚症状もなく本人も認識していないが、わが国では国民8人に一人という推定が提出され新たな国民病とも言うべき普遍的な病態である。この数はにわかに信じられないかもしれないが、わが国の慢性透析患者数が32万人を越え、赤ん坊を含めた日本国民の387人の一人が慢性透析患者ということを思い出せば実感できるであろう2)。特に最大のリスクないし発症要因は加齢であり、わが国はもちろん急速に高齢化が進むアジア諸国や地域(大韓民国・中華人民共和国・台湾・シンガポールなど)では大きな社会問題となっている。こうした年齢層は骨代謝の最大の疾患である骨粗鬆症の発症群とほぼ重なる。
逆に言うと骨粗鬆症患者はあまねくCKD患者と言っても過言ではない状況である。腎臓内科達は多くはこの現状を理解認識しており、CKDに伴う骨代謝異常(CKD-MBD:CKD related Mineral Bone disorder)として、治療面でも研究面でも活発な分野となっている3, 4)。
すなわちCKDこそが続発性骨粗鬆症の最大原因疾患であるのみならず、原発性骨粗鬆症の普遍的な併存疾患である。しかしながら、骨代謝研究や診療に対する従事者達は、このことをあまり重要視していないような場面にも遭遇することがある。
本稿ではこうした背景をもって、血管石灰化を中心に論じてみる。
II.血管石灰化と生命予後
生体において体内Ca総量は加齢に伴ってやや増加していくか・または普遍とされる。しかしながら骨など硬組織は明らかにCaの含有量は程度に差はあるものの減少傾向が認められる。そうならば[体内Ca総量—骨などの硬組織Caの含有量]は増加していくはずである。この増加分のCaはどこへ行くのだろうか?
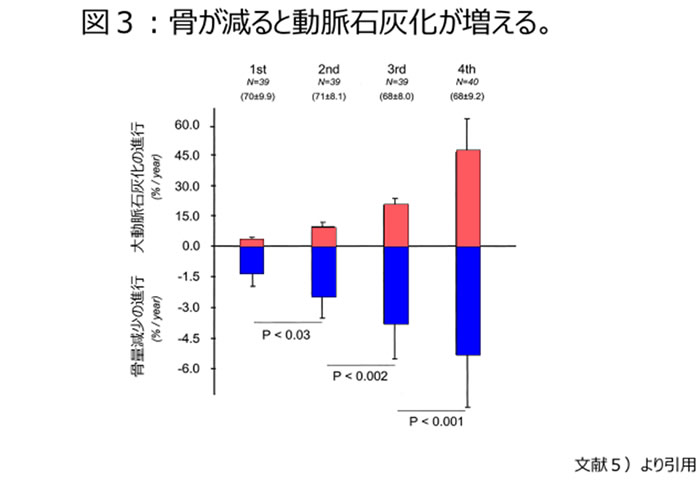
硬組織やCaにはあまり縁が無い脂肪組織を除けば、筋肉や血管などの軟部組織にCaが移動するしか無いであろう。実際、骨のCa含量の減少は血管石灰化の増量という研究結果が出ている【図3】5)。
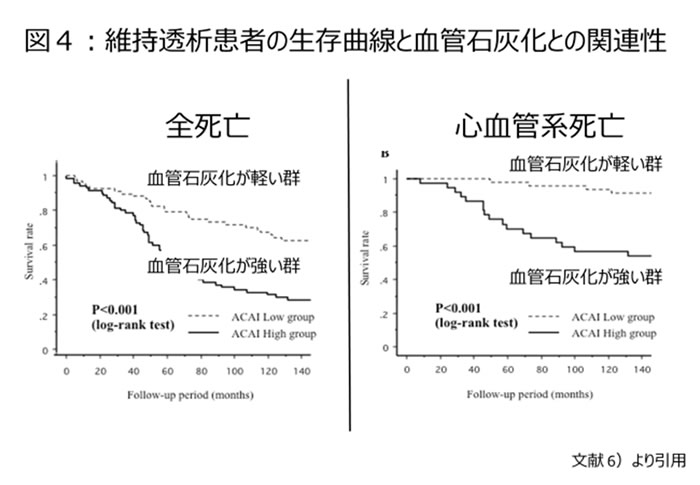
我々はこの血管石灰化を、慢性維持透析患者において腹部大動脈のCT撮影横断面からACI(Aortic Calcification Index)を算出し、10年以上の長期に渡って観察している。血管石灰化の強い例では明らかに生命予後は悪く、特に心血管疾患による死亡に関連していることを観察している【図4】6)。
フランスのLondon Gらも骨代謝と密接に関連する血管中膜に限っても、血管中膜石灰化の強い例では明らかに生命予後は悪いと報告している7)。この他にも多くの血管石灰化程度と生命予後と関係するという研究成果は枚挙にいとまがない。更には骨粗鬆症患者において、骨密度が低い症例や骨量減少の高度例では生命予後が悪いという観察研究も報告されている8, 9)。
こうしたことを考えると、骨量の減少した骨粗鬆症患者におけるリスクは骨折と死と考えられる。骨粗鬆症の最大合併症である大腿骨近位部骨折例は生命予後が極めて不良であることは、骨代謝の研究者ではよく知られている事実である10, 11)。
しかし大腿骨近位部骨折例は骨折そのもので死に至るわけではない。感染症か腎機能悪化そして心血管病で生命が侵されていくのである。
III.血管石灰化進展の機序と予防策(血管中膜石灰化を中心に)
1)血管内膜の石灰化
血管内膜の石灰化が高LDL−C血症や低HDL−C血症のような脂質代謝異常と大きな関連性を有することは論を待たない。いわゆる粥状動脈硬化症である。血圧のコントロールや肥満解消・運動・禁煙など、古典的な虚血性心疾患のリスク解消や軽減が有効である。この中で薬物療法として、LDL−C低下作用や低HDL−C上昇作用を有する薬剤にスタチン製剤がある。スタチン製剤は粥状硬化性の動脈プラークの予防や減衰にも有効である12)。その結果から腎機能に問題がない症例では、明らかに生命予後を改善するという大規模疫学研究がある13)。しかしながら、血管中膜石灰化を主体とするCKD患者である慢性維持透析患者では、スタチン製剤の効果は多数例の大規模疫学研究でも観察できなかった14)。
2)血管中膜の石灰化
(1)高リン血症もしくはリン負荷による血管中膜石灰化促進
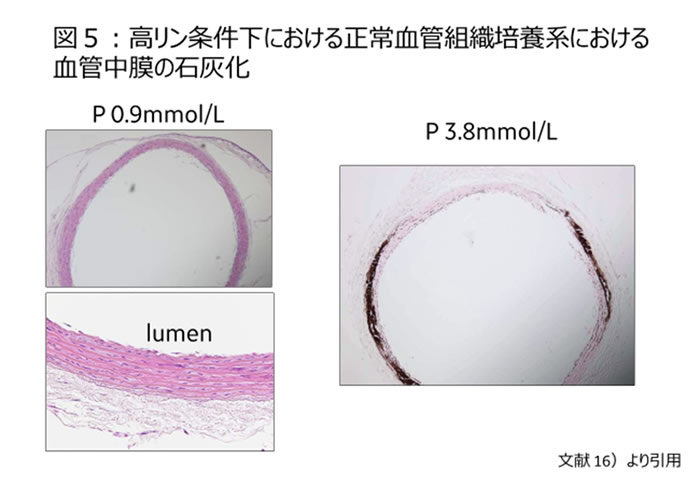
高リン血症が血管中膜石灰化と密接な関係を示すことは既に明らかにされている15)。これをより端的に示すin vitro実験を我々は行い、リン負荷そのものが血管中膜の石灰化を直接惹起することを示した。実際にはラットの大動脈の組織培養を行い、高リン条件下でex vivo環境として培養することで動脈中膜石灰化を忠実に再現することができた【図5】16)。
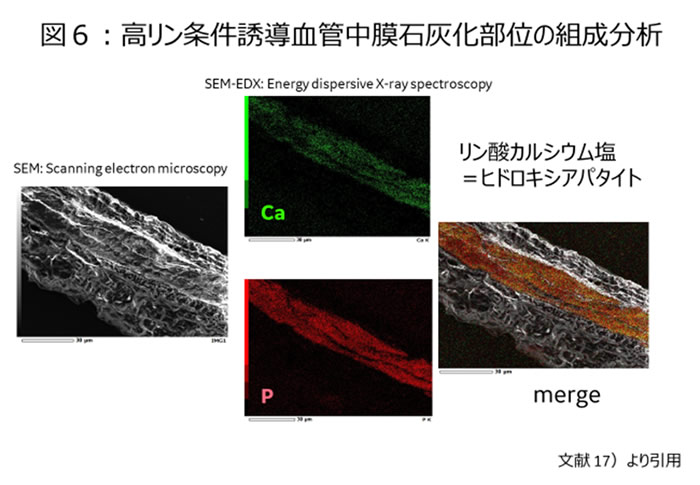
しかもこの中膜石灰化を解析することにより、中膜石灰化はリン酸カルシウム成分からできていることを証明した【図6】17)。この事実は取りも直さず、血管中膜が骨組織に変化したことをいみじくも示している。実際に骨・特に骨形成マーカーが高リン負荷により発現上昇していることが血管閉殻筋細胞培養の系で示されている。
(2)生体におけるリン調節機構
単純に考えれば、高リン負荷の除去が血管中膜石灰化の抑制につながることは容易に想像がつく。しかしながら、リンは核酸の成分であり、細胞はリン脂質からなる細胞膜で形成されている。また細胞内のSecond Messengerとしてcyclic-AMPやInositol P3(3リン酸)などは有名であり、高エネルギー化合物であるアデノシン3リン酸(ATP)はエネルギー供給源として極めて重要な生体機能を有している。このため高リン負荷も障害となるがリン欠乏も生体にとっては重大な障害原因となる。このために厳格なリン代謝調節機構が存在し、近年その機構が明らかにされてきている。
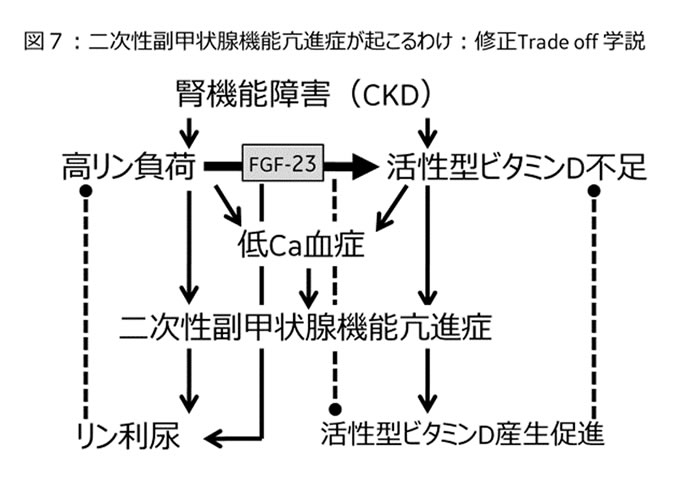
本稿でこのリン調節機構の詳細について記載する紙面の余裕は無いが、リン代謝調節における最大の調節臓器は腎臓である。すなわち腎臓の調節機構が維持されている限り、障害となる高リン血症が発症することはない。しかし腎疾患や骨粗鬆症を伴う加齢により腎機能が低下してくる慢性腎臓病(CKD)になってくると、【図7】のような機序で二次性副甲状腺機能亢進症を発症進展させることで、高リン血症や低Ca血症を予防している。
この中で重要な役割を示すホルモンが、副甲状腺ホルモン(PTH)と骨組織(骨細胞が中心)となる線維芽細胞増殖因子(FGF)23である。このFGF23はCKD患者においては、活性型Vitamin Dにより産生が促進され、逆にVitamin Dの活性化を抑制していることが明らかとなっている18)。何よりも腎機能の著しく低下したCKD例である維持透析患者では、その血中濃度は生命予後と密接な関係が指摘されており注目される19)。
(3)血管中膜石灰化の抑制
幾つかの抑制方法が考えられるが、本稿では骨代謝と密接に関連するリン負荷の軽減策を中心に記載する。
a.高リン負荷の軽減:リン制限食
生体内にリンが入るin putは経口的経路となる。従って経口的リン負荷の軽減=食事中のリン制限が中心となる。リンは種々の食品、言い換えればあらゆる食品に含まれている。特に蛋白質は1.0当たり平均で15.0mgのリンが含まれているため、リン制限食は蛋白制限食とほぼ同意味になる20)。このたんぱくとリン含有量の正相関関係から外れた、蛋白豊富な食品でありながらリンがごくわずかしか含まれていない食品である卵白は極めて優秀な食品と言うことができる。CKD患者においては腎機能の保持ないし低下抑制に、程度の強弱はあれ多くはたんぱく制限食が基本となる。これはリン制限食とほぼ同意であり、たんぱく制限食の効果はリン制限のための可能性も十分ある。
しかしながら、食品の加工技術が進歩した現在では、いわゆる高蛋白食よりリン含有量を左右しているのは添加物である。添加物は食品の食感の改善や見栄えの良さを実現するために、ありとあらゆる食品に含まれていると言っても過言ではない。特に自然食品ではなく加工食品や調整飲料には大量の添加物を通じて大量のリンが含まれている。こうした高添加物食品を自然食品中心の食品に変更するだけで、CKD患者においてリン負荷が大きく改善され血清リン濃度も低下するという前向き介入研究の結果も報告されている21)。
ただ大きな問題は、わが国を含め世界各国で食品中のリン含有量の表示はなされていない。ナトリウム(Na)や脂肪含有量やカロリー等は明記されている。今後、リン含有量の把握の困難さという問題を克服して、多くの食品においてリン含有量の表示がなされることを希望している。
b.高リン負荷の軽減:リン低下薬(リン吸着薬)
リン代謝においては既に記載したとおり、腎臓からの尿中リン排泄が大きな部分を占めている。逆に言うと経口摂取されたリンの腸管からの吸収は重要な因子ではあるが、一定量の吸収(60-75%)が行われ変動が少ないことを示している。一義的には経口的なリン摂取量が規定していることになる。この吸収率を低下させる薬剤がリン吸着剤である。リン吸着薬は腸管内で不溶性の吸収しにくいリン化合物を形成し、腸管からのリン吸収率を低下させる薬剤であり、結果的に血清リンを下げることのできるリン低下薬となる。現在、わが国では透析患者も含めたCKD患者に対しては、6種類のリン吸着薬が使用可能である【図8】。
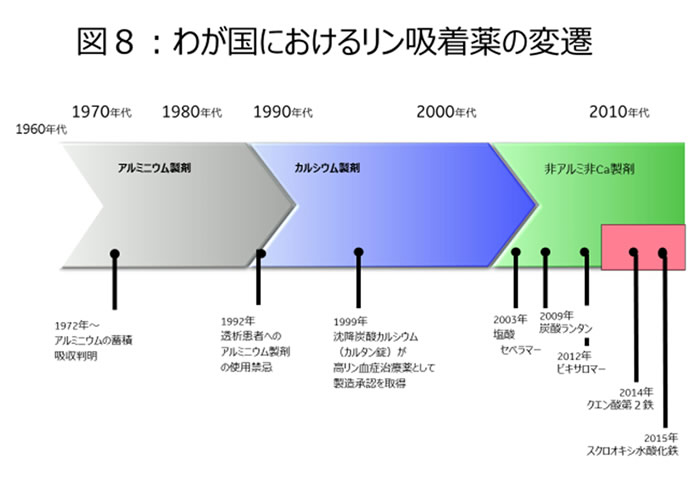
その詳細は紙面の都合から省くが、リン吸着力の強力なアルミニウム製剤は、生体における蓄積毒性の点から重篤な腎機能低下例には菌にとなっているため、1.カルシウム製剤 2.非カルシウム製剤の2種類に大きく大別される。カルシウム製剤は次項にて詳述するが、血管石灰化を促進する可能性が高く、血管石灰化予防の観点から最近では投与量の抑制と使用頻度の低下が観察されている。このため中膜石灰化を中心とする血管石灰化予防には、非カルシウム系のリン吸着剤が中心となる。具体的にも透析患者において、血管石灰化が予防されたとの報告が散見される22-24)。
c.カルシウム製剤による血管石灰化促進作用
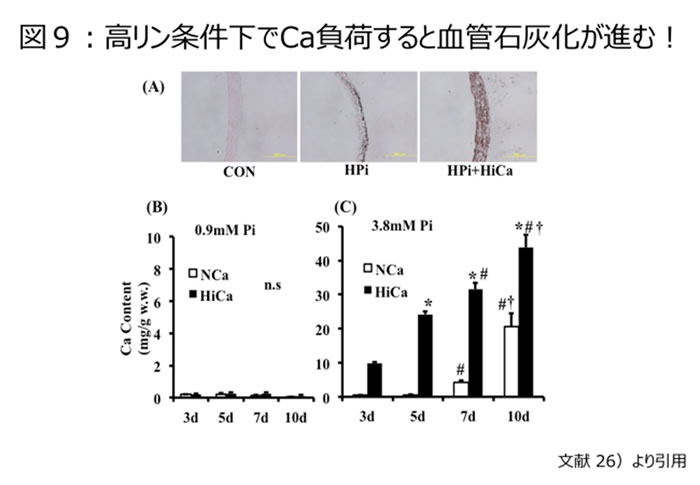
カルシウム製剤によるCa負荷は、血清Ca濃度を上昇させリン負荷と相まってCa × リン積の増大を来す。Ca × リン積>=55.0では血管石灰化が進む現象を我々は観察報告している25)。更にはCa負荷はリンによる血管中膜石灰化現象を促進することが、血管組織培養系の研究から確認されている【図9】26)。
これはリン負荷による血管中膜石灰化が、更なるCa負荷により増強されることからも証明されている。このような観点からは、いたずらに活性型Vitamin D製剤投与によるCa × リン積を上昇させたり、腎機能が低下し潜在的なCKD患者とも考えられる骨粗鬆症患者においてはCa摂取量の増大やCa負荷を増大させることは無意味であることを通り越して、生体にとってマイナス効果を生む可能性もあることを認識すべきである。高齢の骨粗鬆症患者にCa負荷を行うと生命予後を悪化させるという逆説的な報告もなされているのが現状である27)。
d.マグネシウム(Mg)による血管石灰化並びにリン毒性の軽減
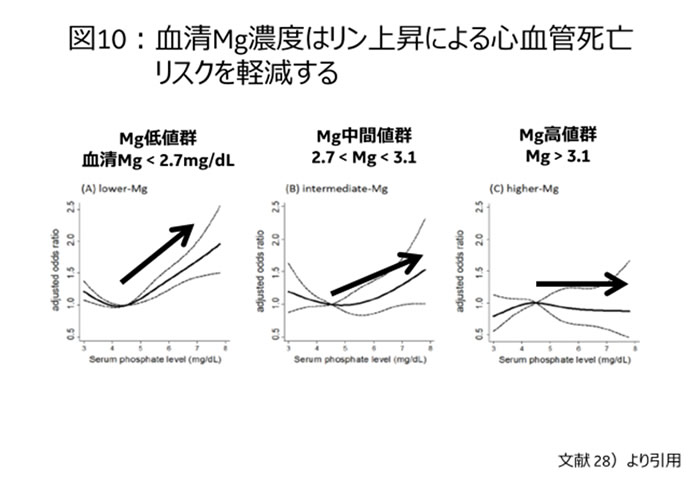
Mgは自然界におけるCa拮抗薬とも称される。事実、副甲状腺を始め各種臓器に存在するCa感受性受容体(CaSR:Calcium Sensing Receptor)はCa以外にも同様の2価イオンであるMg2にも反応することができる。しかもCaのリン毒性の相乗効果とは異なり、リン毒性の軽減効果が知られている。わが国における全透析患者のデータベースである一般社団法人日本透析医学会のデータベースから、高リン血症による生命予後悪化が血中Mg濃度の高さに応じて抑制できるという大規模観察研究が報告され注目されている28) 【図10】。
しかも、生命予後を抑制するレベルは、従来の腎機能正常者における高Mg血症レベルということが注目される。この事実は、末期腎不全患者では腎機能低下とともにMgレベルは上昇していくという大矢らの報告29)から、高Mg血症を呈するのは生命予後リスク軽減のための防御的適応現象と考えても良いかもしれない。
同報告ではその生命予後改善効果は示されていないが、透析患者の最大死因が心不全であることを考えると、心血管病のリスク軽減と考えるのが自然である。もともとMgには抗不整脈作用があることが知られている30)。更にはMgの直接的な血管保護作用も血管組織培養系実験から我々は明らかにしている。高リン条件下で血管を組織培養することで血管中膜石灰化現象をex vivoで再現することに成功した事は既に述べた。この実験条件にMg負荷を加えることで血管中膜石灰化が抑制されることが明らかになった31)【図11】。
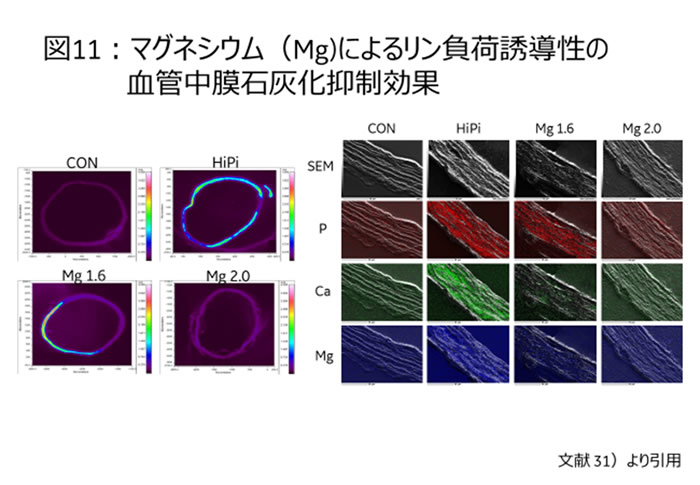
今後、このMgの臓器保護作用は注目に値する。また実臨床ではCa毒性を軽減しつつリン吸着力を高めたCa+Mgのリン低下薬の検討もなされている32)。今後の進展に注目したい。
e.骨吸収抑制による血管石灰化予防
ヒトの生体においてリンが最も大量に存在するのは硬組織・主に骨組織である。骨組織はリンの8~9割のリンが存在するとされている。従って骨吸収が抑制されれば、骨からのリン遊離が抑制され内因性のリン負荷の軽減となる。逆に言うと骨吸収が亢進し骨量が減少していけば、内因性のリン負荷が継続し結果として血管石灰化が進むことが知られている。すでに【図3】に示したように、骨塩量と血管石灰化は負の相関関係が存在することが明らかとなっている5)。
骨吸収を抑制する手段としては、薬物療法を含めた種々の報告があるが、CKD患者・特に腎機能の著しく低下した維持透析患者では、二次性副甲状腺機能亢進症の抑制が骨吸収を抑制し血清リン濃度を低下させる最も効果的な手段となる。
そのうちでも外科的副甲状腺摘出術(PTX:Parathyroidectomy)は、一過性の骨形成促進作用と相まって血清リンのみならず血清Caレベルを著しく低下させるHungry Bone Syndromeの状況となる33)。このPTXは血管石灰化を長期的には進展を抑制し34)、生命予後も改善することが報告されている35)。
同様のことが薬物的な副甲状腺摘出術とも言われるCalcimimetics療法でも報告されている。その一つのCinacalcet療法は血管石灰化はもちろんのこと、大動脈弁などの心臓弁膜の石灰化も抑制することが可能である36)。その機序としては、静注Calcimimetics製剤であるEtelcalcetide療法でPTH・血清リン・血清Ca濃度の低下を実現し、血清Ca × リン積の低下を実現することが明らかとなっている37)。この点、同じ二次性副甲状腺機能亢進症治療薬剤である活性型ビタミンD製剤では、血清Ca値の上昇のみならず血清リン値を上昇させる可能性があり、少なくとも血管石灰化抑制という観点からはプラス効果は余り期待できないだろう。
代表的な骨吸収抑制薬としてはビスフォスフォネート製剤が有る。すでにわが国のCKD患者においてResedoronateが骨塩量維持に有効である報告がある38)。他のビスフォスフォネート製剤であるAlendoronateやEtidoronateでもCKD患者である腎移植患者や維持血液透析患者で血管石灰化進展の抑制が報告されており、個々の製剤というよりもビスフォスフォネート製剤に普遍的に見られる効果かもしれない39, 40)。
最近になり、ビスフォスフォネート製剤の血管石灰化抑制は、骨吸収抑制による内因性のリン負荷軽減のみならず、リン酸カルシウム結晶とFetuin-Aの結合物であるCalciProtein Particles (CPPs) の産生抑制を通じて血管石灰化を抑制する機序も想定されている41)。
同様に強力な骨吸収抑制薬の抗RANKL抗体であるDenosumabでも、血管石灰化抑制や心血管病の抑制が期待されるが、現時点では3年間の期間では血管石灰化抑制や心血管病の抑制は認めなかったとの報告がある42)。このため血管石灰化抑制には骨吸収抑制機序よりもCPPs産生抑制のほうが主たる可能性の機序が想定できるかもしれない。
ビタミンKは生体内でのGla化蛋白の産生促進に重要な役割を果たしている。Gla化蛋白の一つに石灰化抑制因子であるMatrix Gla Protein(MGP)がある43)。ビタミンK欠乏ではMGPに代表されるGla蛋白の欠乏を招き血管石灰化が進行することが予想される。
CKD患者においては重篤な血管石灰化病変であるCalciphylaxis(calcific uremic arteriolopathy)の危険因子として、ビタミンK拮抗薬であるワーファリン使用が有名である44)。ビタミンK2製剤もわが国では骨粗鬆症患者には使用可能である。二次性の骨粗鬆症合併疾患であるCKD患者にも投与は行われているが、MGPと血管石灰化の相関関係は報告されているものの45)、まとまった血管石灰化との関連性を前向きに介入した上質な研究は殆どない。
IV. おわりに:骨と血管
これまで述べてきたように、骨と血管は密接な関係がある。世界に先駆けて超高齢社会に突入した我が国にとって骨粗鬆症対策は重要である。また治療薬も種々提出されてきている。しかしながら、骨折予防という観点に立てば、既に十分な効果を来す薬物療法は存在する。今後は薬物療法以上に生活習慣の改善、特に転倒予防の筋肉トレーニングや運動療法並びにリハビリテーションがより重要になる。今後は医療経済の点からも薬物療法の地位は低下し、運動療法の地位が上昇していくことは時代の流れであろう。その観点から、腎臓リハビリテーション学会が創設され46)、現在では保険診療を巻き込んで拡大を続けているところである。
また骨粗鬆症治療も生命予後に関連することから、骨折のみならず血管石灰化などを通じた心血管疾患抑制という観点が必須となり、今後益々クローズアップされていくことは間違いないだろう。本稿が日常診療を進めていく上での、診療態度の深化の一助となることを祈っている。
参考文献
1. Preventive Strategies for Vascular Calcification in Patients with Chronic Kidney Disease.
Shigematsu T, Sonou T, Ohya M, Yokoyama K, Yoshida H, Yokoo T, Okuda K, Masumoto AR, Iwashita Y, Iseki K, Kunimoto S, Yamano Y.
Contrib Nephrol. 2017;189:169-177
2. Annual Dialysis Data Report 2014, JSDT Renal Data Registry (JRDR).
Masakane I, Nakai S, Ogata S, Kimata N, Hanafusa N, Hamano T, Wakai K, Wada A, Nitta K
Renal Replacement Therapy 2017 3:18
3. Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what's changed and why it matters.
Ketteler M, Block GA, Evenepoel P, Fukagawa M, Herzog CA, McCann L, Moe SM, Shroff R, Tonelli MA, Toussaint ND, Vervloet MG, Leonard MB
Kidney Int. 2017; 92:26-36. doi: 10.1016/j.kint.2017.04.006.
4. Clinical practice guideline for the management of chronic kidney disease-mineral and bone disorder.
Fukagawa M, Yokoyama K, Koiwa F, Taniguchi M, Shoji T, Kazama JJ, Komaba H, Ando R, Kakuta T, Fujii H, Nakayama M, Shibagaki Y, Fukumoto S, Fujii N, Hattori M, Ashida A, Iseki K, Shigematsu T, Tsukamoto Y, Tsubakihara Y, Tomo T, Hirakata H, Akizawa T; CKD-MBD Guideline Working Group; Japanese Society for Dialysis Therapy. Akizawa T, Hirakata H, Tomo T, Fukagawa M, Yokoyama K, Ando R, Kakuta T, Taniguchi M, Fujii N, Fujii H, Kazama JJ, Komaba H, Shoji T, Hattori M, Ashida A, Nakayama M, Koiwa F, Shibagaki Y, Fukumoto S, Iseki K, Shigematsu T, Tsukamoto Y, Tsubakihara Y.
Ther Apher Dial. 2013 ;17:247-88. doi: 10.1111/1744-9987.12058.
5. Aortic calcification and the risk of osteoporosis and fractures.
Schulz E, Arfai K, Liu X, Sayre J, Gilsanz V
J Clin Endocrinol Metab. 2004;89 :4246-53
6. Vascular calcification estimated by aortic calcification area index is a significant predictive parameter of cardiovascular mortality in hemodialysis patients.
Ohya M, Otani H, Kimura K, Saika Y, Fujii R, Yukawa S, Shigematsu T
Clin Exp Nephrol. 2011;15:877-83. doi: 10.1007/s10157-011-0517-y.
7. Arterial calcifications, arterial stiffness, and cardiovascular risk in end-stage renal disease.
Blacher J, Guerin AP, Pannier B, Marchais SJ, London GM
Hypertension. 2001;38:938-942.
8. Bone Mineral Density and Parathyroid Hormone as Independent Risk Factors for Mortality in Community-Dwelling Older Adults: A Population-Based Prospective Cohort Study in Brazil. The S?o Paulo Ageing & Health (SPAH) Study.
Domiciano DS, Machado LG, Lopes JB, Figueiredo CP, Caparbo VF, Oliveira RM, Scazufca M, McClung MR, Pereira RM
J Bone Miner Res. 2016;31(6):1146-57. doi: 10.1002/jbmr.2795.
9. Higher prevalence of morphometric vertebral fractures in patients with recent coronary events independently of BMD measurements.
Silva HC, Pinheiro MM, Genaro PS, Castro CH, Monteiro CM, Fonseca FA, Szejnfeld VL Bone. 2013;52:562-567. doi: 10.1016/j.bone.2012.11.004.
10. Hip fracture causes excess mortality owing to cardiovascular and infectious disease in institutionalized older people: a prospective 5-year study.
Cameron ID, Chen JS, March LM, Simpson JM, Cumming RG, Seibel MJ, Sambrook PN
J Bone Miner Res. 2010;25:866-72. doi: 10.1359/jbmr.091029.
11. Hip fractures and heart failure: findings from the Cardiovascular Health Study.
Carbone L, Buzkova P, Fink HA, Lee JS, Chen Z, Ahmed A, Parashar S, Robbins JR
Eur Heart J. 2010 ;31:77-84. doi:10.1093/eurheartj/ehp483.
12. Aggressive lipid-lowering is more effective than moderate lipid-lowering treatment in carotid plaque stabilization.
Kadoglou NP, Sailer N, Moumtzouoglou A, Kapelouzou A, Gerasimidis T, Liapis CD
J Vasc Surg. 2010;51:114-121. doi: 10.1016/j.jvs.2009.07.119.
13. Lipid lowering drug therapy in patients with coronary heart disease from 24 European countries--Findings from the EUROASPIRE IV survey.
Reiner Z, De Backer G, Fras Z, Kotseva K, Tokgozoglu L, Wood D, De Bacquer D; EUROASPIRE Investigators.
Atherosclerosis. 2016;246:243-50. doi: 10.1016/j.atherosclerosis.2016.01.018.
14. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis.
Wanner C1, Krane V, Marz W, Olschewski M, Mann JF, Ruf G, Ritz E; German Diabetes and Dialysis Study Investigators.
N Engl J Med. 2005 Jul 21;353(3):238-48.
15. Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic hemodialysis patients: a national study.
Block GA, Hulbert-Shearon TE, Levin NW, Port FK
Am J Kidney Dis. 1998;31:607-617.
16. Mechanism of phosphate-induced calcification in rat aortic tissue culture: possible involvement of Pit-1 and apoptosis.
Mune S, Shibata M, Hatamura I, Saji F, Okada T, Maeda Y, Sakaguchi T, Negi S, Shigematsu T.
Clin Exp Nephrol. 2009;13:571-577. doi: 10.1007/s10157-009-0208-0.
17. Mineral Composition of Phosphate-Induced Calcification in a Rat Aortic Tissue Culture Model.
Sonou T, Ohya M, Yashiro M, Masumoto A, Nakashima Y, Ito T, Mima T, Negi S, Kimura-Suda H, Shigematsu T.
J Atheroscler Thromb. 2015;22:1197-206. doi: 10.5551/jat.28647.
18. The PTH-Vitamin D-FGF23 axis.
Blau JE, Collins MT
Rev Endocr Metab Disord. 2015;16:165-74. doi: 10.1007/s11154-015-9318-z.
19. Fibroblast growth factor 23 and mortality among patients undergoing hemodialysis.
Gutiurrez OM, Mannstadt M, Isakova T, Rauh-Hain JA, Tamez H, Shah A, Smith K, Lee H, Thadhani R, Juppner H, Wolf M
N Engl J Med. 2008;359:584-592. doi: 10.1056/NEJMoa0706130.
20. Diets and enteral supplements for improving outcomes in chronic kidney disease.
Kalantar-Zadeh K, Cano NJ, Budde K, Chazot C, Kovesdy CP, Mak RH, Mehrotra R, Raj DS, Sehgal AR, Stenvinkel P, Ikizler TA
Nat Rev Nephrol. 2011;7:369-84. doi: 10.1038/nrneph.2011.60.
21. Replacing Phosphorus-Containing Food Additives With Foods Without Additives Reduces Phosphatemia in End-Stage Renal Disease Patients: A Randomized Clinical Trial.
de Fornasari ML, Dos Santos Sens YA
J Ren Nutr. 2017;27:97-105. doi: 10.1053/j.jrn.2016.08.009.
22. The effects of sevelamer and calcium acetate on proxies of atherosclerotic and arteriosclerotic vascular disease in hemodialysis patients.
Chertow GM, Raggi P, McCarthy JT, Schulman G, Silberzweig J, Kuhlik A, Goodman WG, Boulay A, Burke SK, Toto RD
Am J Nephrol. 2003;23:307-314.
23. Attenuation of aortic calcification with lanthanum carbonate versus calcium-based phosphate binders in haemodialysis: A pilot randomized controlled trial.
Toussaint ND, Lau KK, Polkinghorne KR, Kerr PG
Nephrology (Carlton). 2011;16:290-298. doi: 10.1111/j.1440-1797.2010.01412.x.
24. PA21, a new iron-based noncalcium phosphate binder, prevents vascular calcification in chronic renal failure rats.
Phan O, Maillard M, Peregaux C, Mordasini D, Stehle JC, Funk F, Burnier M
J Pharmacol Exp Ther. 2013;346:281-9. doi: 10.1124/jpet.113.204792.
25. Phosphate overload accelerates vascular calcium deposition in end-stage renal disease patients.
Shigematsu T, Kono T, Satoh K, Yokoyama K, Yoshida T, Hosoya T, Shirai K
Nephrol Dial Transplant. 2003 Jun;18 Suppl 3:iii86-9.
26. Calcium Overload Accelerates Phosphate-Induced Vascular Calcification Via Pit-1, but not the Calcium-Sensing Receptor.
Masumoto A, Sonou T, Ohya M, Yashiro M, Nakashima Y, Okuda K, Iwashita Y, Mima T, Negi S, Shigematsu T.
J Atheroscler Thromb. 2017;24:716-724. doi: 10.5551/jat.36574.
27.Calcium supplements with or without vitamin D and risk of cardiovascular events: reanalysis of the Women's Health Initiative limited access dataset and meta-analysis.
Bolland MJ, Grey A, Avenell A, Gamble GD, Reid IR
BMJ. 2011;342:d2040. doi: 10.1136/bmj.d2040.
28. Magnesium modifies the cardiovascular mortality risk associated with hyperphosphatemia in patients undergoing hemodialysis: a cohort study.
Sakaguchi Y, Fujii N, Shoji T, Hayashi T, Rakugi H, Iseki K, Tsubakihara Y, Isaka Y; Committee of Renal Data Registry of the Japanese Society for Dialysis Therapy
PLoS One. 2014;9:e116273. doi: 10.1371/journal.pone.0116273.
29. Significance of serum magnesium as an independent correlative factor on the parathyroid hormone level in uremic patients.
Ohya M, Negi S, Sakaguchi T, Koiwa F, Ando R, Komatsu Y, Shinoda T, Inaguma D, Joki N, Yamaka T, Ikeda M, Shigematsu T
J Clin Endocrinol Metab. 2014;99:3873-8. doi: 10.1210/jc.2013-4396.
30. Effects of magnesium sulfate on cardiac conduction and refractoriness in humans.
DiCarlo LA Jr, Morady F, de Buitleir M, Krol RB, Schurig L, Annesley TM
J Am Coll Cardiol. 1986;7:1356-62
31. Magnesium prevents phosphate-induced vascular calcification via TRPM7 and Pit-1 in an aortic tissue culture model.
Sonou T, Ohya M, Yashiro M, Masumoto A, Nakashima Y, Ito T, Mima T, Negi S, Kimura-Suda H, Shigematsu T.
Hypertens Res. 2017;40:562-567 doi: 10.1038/hr.2016.188.
32. Evaluation of calcium acetate/magnesium carbonate as a phosphate binder compared with sevelamer hydrochloride in haemodialysis patients: a controlled randomized study (CALMAG study) assessing efficacy and tolerability.
de Francisco AL, Leidig M, Covic AC, Ketteler M, Benedyk-Lorens E, Mircescu GM, Scholz C, Ponce P, Passlick-Deetjen J
Nephrol Dial Transplant. 2010;25:3707-17. doi: 10.1093/ndt/gfq292.
33. Biochemical aberrations in a dialysis patient following parathyroidectomy.
Cruz DN, Perazella MA.
Am J Kidney Dis. 1997;29:759-62
34. Regression of vascular calcification in a parathyroidectomized patient on dialysis with untreated hypocalcemia over 12-year follow-up
Molina P, Gorriz JL, Beltran S, Vizcaino B, Pallardo LM
Clin Nephrol. 2016;86:333-339
35. Parathyroidectomy and survival among Japanese hemodialysis patients with secondary hyperparathyroidism.
Komaba H, Taniguchi M, Wada A, Iseki K, Tsubakihara Y, Fukagawa M
Kidney Int. 2015;88:350-9. doi: 10.1038/ki.2015.72.
36. The ADVANCE study: a randomized study to evaluate the effects of cinacalcet plus low-dose vitamin D on vascular calcification in patients on hemodialysis.
Raggi P1, Chertow GM, Torres PU, Csiky B, Naso A, Nossuli K, Moustafa M, Goodman WG, Lopez N, Downey G, Dehmel B, Floege J; ADVANCE Study Group.
Collaborators (92) : Abdallah J, Adragao T, Amato M, Amguhl P, Anderson J, Balla J, Bannister K, Bansal V, Block G, Bock A, Braun J, Busse J, Cerda J, Chidester P, Chonchol M, Chow S, Corry D, Cournoyer S, Csiky B, Curley T, Disney A, Donnelly S, Durand D, Eisenbach G, Fassett R, Ferenczi S, Floege J, Geronemus R, Ghantous W, Gurevich A, Gurevich K, Hawley C, Helantera A, Heyka R, Himot E, Hodsman A, Honkanen E, Irish A, Javier R, Jofre R, Joly D, Shashi Kant K, Kaplan M, Kiss I, Lajos N, Leblanc M, Locatelli F,
37. Lok C, Malecki R, Mendelssohn D, Messa P, Metsarinne K, Minga T, Moist L, Moustafa M, Naso A, Nassri M, Newman GE, Nossuli K, Pearlman A, Pedagogos E, Pereira O, Portol?s J, Qunibi W, Antonio S, Qureshi J, Rakowski T, Rappaport K, Roger S, Roppolo M, Roy L, Rydzewski A, Samik J, Sanchez-Hernandez R, Sanz Guajardo D, Shahmir E, Sharma A, Shemin D, Silberzweig J, Sohi P, Sprague A, Sprague S, Suchinda P, Sulowicz W, Suranyi M, Tharpe D, Urena Torres P, Villa G, Wadhwa N, Wankowicz Z, Wuethrich R, Zemtchenkov A.
Nephrol Dial Transplant. 2011;26:1327-39. doi: 10.1093/ndt/gfq725.
Long-term effects of etelcalcetide as intravenous calcimimetic therapy in hemodialysis patients with secondary hyperparathyroidism.
Shigematsu T, Fukagawa M, Yokoyama K, Akiba T, Fujii A, Odani M, Akizawa T; ONO-5163 Study Group.
Collaborators (41) : Kukita K, Sunaoshi K, Sato T, Fukaya Y, Kobayashi M, Takemura K, Ito K, Morioka J, Oshima J, Takeda F, Fujii T, Takao K, Murotani N, Suda A, Komatsu Y, Emoto H, Suzuki T, Ozawa T, Aruga S, Yamaguchi Y, Nishihara M, Shibata K, Kuji T, Mitsuhashi T, Kageyama S, Tsuboi M, Kasuga H, Onogi T, Sato T, Tsujimoto Y, Akagaki Y, Kodama N, Matsuoka Y, Arimoto K, Omoto M, Yuasa K, Ota K, Hazama T, Higashi H, Mitsuiki K, Otsubo T
Clin Exp Nephrol. 2017 in press doi: 10.1007/s10157-017-1442-5
38. Risedronate therapy in patients with mild-to-moderate chronic kidney disease with osteoporosis: post-hoc analysis of data from the risedronate phase III clinical trials.
Shigematsu T, Muraoka R, Sugimoto T, Nishizawa Y
BMC Nephrol. 2017;18:66. doi: 10.1186/s12882-017-0478-9.
39. Alendronate as an effective treatment for bone loss and vascular calcification in kidney transplant recipients.
Okamoto M, Yamanaka S, Yoshimoto W, Shigematsu T.
J Transplant. 2014; 2014:269613 doi: 10.1155/2014/269613
40. Inhibitory effects of etidronate on the progression of vascular calcification in hemodialysis patients.
Hashiba H, Aizawa S, Tamura K, Shigematsu T, Kogo H.
Ther Apher Dial. 2004;8:241-7.
41. Phosphorylated fetuin-A-containing calciprotein particles are associated with aortic stiffness and a procalcific milieu in patients with pre-dialysis CKD.
Smith ER, Ford ML, Tomlinson LA, Rajkumar C, McMahon LP, Holt SG
Nephrol Dial Transplant. 2012;27:1957-66 doi: 10.1093/ndt/gfr609
42. RANKL inhibition with denosumab does not influence 3-year progression of aortic calcification or incidence of adverse cardiovascular events in postmenopausal women with osteoporosis and high cardiovascular risk.
Samelson EJ1, Miller PD, Christiansen C, Daizadeh NS, Grazette L, Anthony MS, Egbuna O, Wang A, Siddhanti SR, Cheung AM, Franchimont N, Kiel DP
J Bone Miner Res. 2014;29:450-7 doi: 10.1002/jbmr.2043
43. Molecular mechanisms mediating vascular calcification: role of matrix Gla protein.
Proudfoot D, Shanahan CM
Nephrology (Carlton). 2006;11:455-61
44. A case-control study of calciphylaxis in Japanese end-stage renal disease patients.
Hayashi M, Takamatsu I, Kanno Y, Yoshida T, Abe T, Sato Y; Japanese Calciphylaxis Study Group
Nephrol Dial Transplant. 2012;27:1580-4 doi: 10.1093/ndt/gfr658
45. Dephosphorylated-uncarboxylated Matrix Gla protein concentration is predictive of vitamin K status and is correlated with vascular calcification in a cohort of hemodialysis patients.
Delanaye P, Krzesinski JM, Warling X, Moonen M, Smelten N, Médart L, Pottel H, Cavalier E
BMC Nephrol. 2014;15:145 doi: 10.1186/1471-2369-15-145
46. 日本腎臓リハビリテーション学会 https://jsrr.jimdo.com