※お客様のご使用経験に基づく記載です。仕様値として保証するものではありません。
はじめに
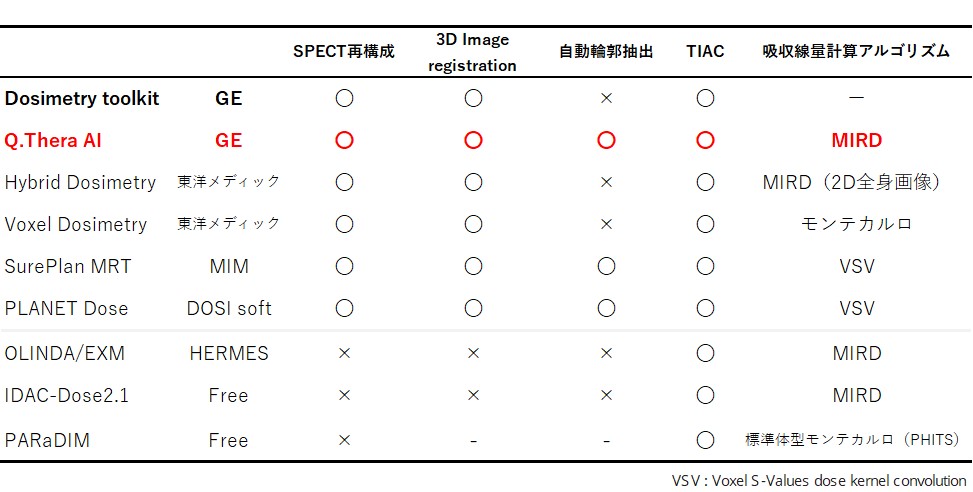
2021年にソマトスタチン受容体陽性の神経内分泌腫瘍を対象とした、日本で初めてのペプチド受容体放射性核種療法(PRRT)剤であるルテチウムオキソドトレオチド(177Lu-DOTATATE)が承認使用されてから2年が経ちました。 多くの施設でPRRTが実施される中で、核医学画像を用いた内部被ばく線量推定(ドシメトリー)の需要が高まり、様々な手法が開発されています(表1)。 ドシメトリーによる吸収線量の算出精度に影響を与える因子は、MIRD法やモンテカルロシミュレーション法などの線量算出アルゴリズムの他に、撮像・再構成条件や撮像頻度およびタイミングなど多数存在します。中でも輪郭抽出に起因する誤差は、操作者の熟練度により回避可能であり、十分なトレーニングが吸収線量算出精度の担保に繋がります。
GE Healthcare社により提供されるQ.Thera AIは、既存のXelerisアプリケーション Dosimetry toolkitにAIを用いた自動輪郭抽出機能を加え、再構成から線量算出までを1つのアプリケーションで完結できるドシメトリー解析ソフトウェアです。そこで、Q.Thera AIによる臓器の自動抽出が、どのようにドシメトリーに影響するのかを当院の使用経験を踏まえご紹介致します。
表1.核医学治療に用いられる主なドシメトリーソフトウェア
Q.Thera AIの利点
Q.Thera AIは、MIRD法に基づく患者内部被ばく線量を推定するソフトウェアであり、先代のDosimetry Toolkitに肺、肝臓、腎臓の自動輪郭抽出機能と臓器ごとに算出した時間積分活動係数(Time-Integrated Activity Coefficient)からGy単位の吸収線量の算出を加えた、核医学画像を用いたドシメトリーを一つのアプリケーション内で完結できるパッケージです。 自動輪郭抽出の中でも、特に腎臓の抽出は容易であり、図1に示すような腎臓を囲う3次元の関心領域(上段黄色枠)を設定すると、十数秒で腎臓の輪郭を囲ってくれます。
ドシメトリーにおいて輪郭抽出は吸収線量算出精度に影響する非常に重要なファクターであり、慎重を要する作業です。 Th. I. Götsらは、腎臓の領域抽出により、5.4%の不確実性が存在すると報告しています(Ann Nucl Med. 2019 Jul;33(7):521-531)が、当院ではQ.Thera AIを用いることで、短時間で精度よく腎臓の領域を抽出できています。
また、Q.Thera AIでは、TIACから吸収線量を算出するところまで一つのアプリケーション内で行えることも、Dosimetry Toolkitからの大きな進歩と言えます。 Dosimetry Toolkitでは、算出されたTIACをOLINDA等の外部ソフトウェアに入力し吸収線量を計算していましたが、Q.Thera AIの中で、吸収線量が算出されますので、そのまま結果を画像として保存・出力することが可能です。
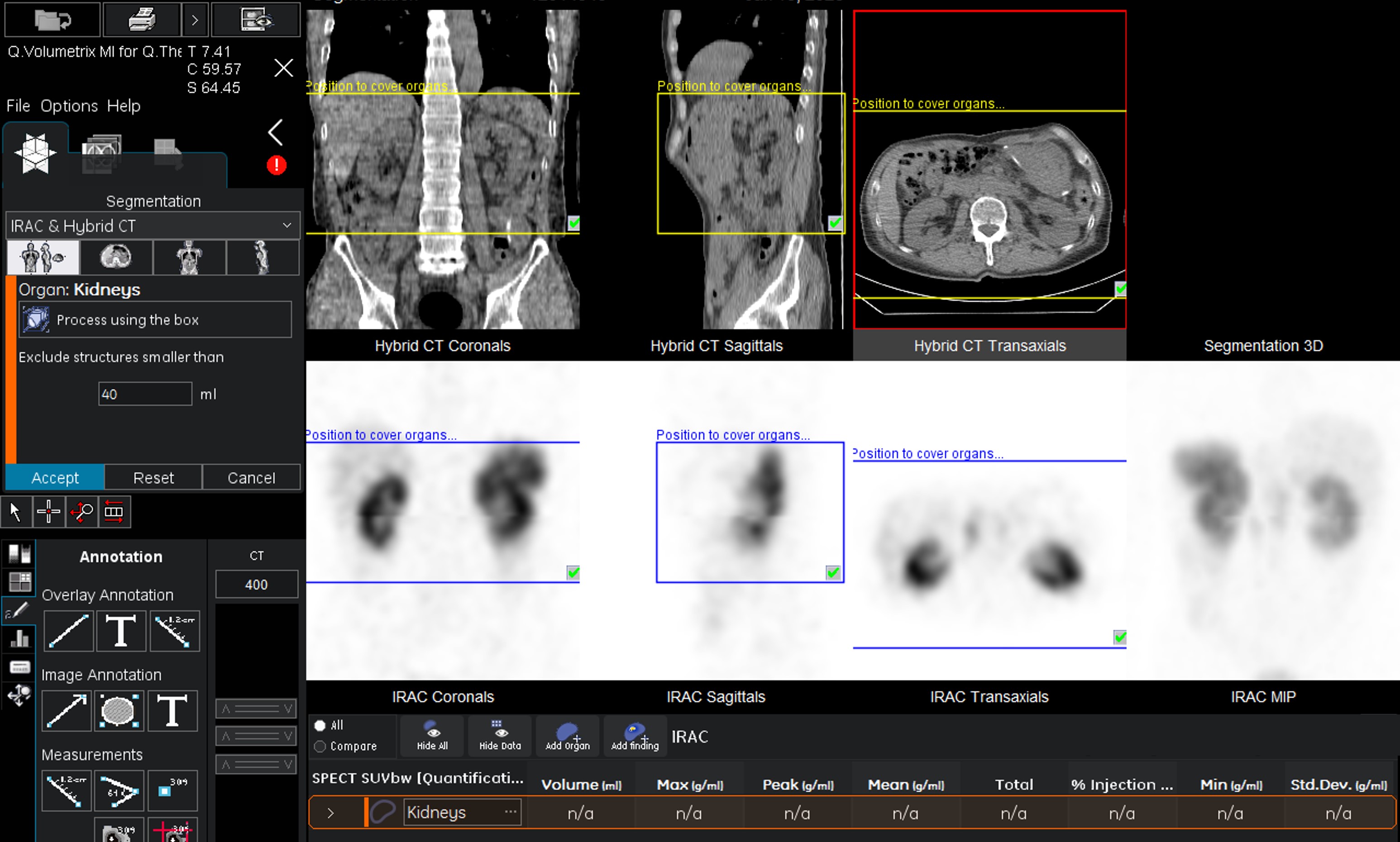
図1.Q.Thera AIにおける腎臓自動抽出画面
当院のDosimetry challenge
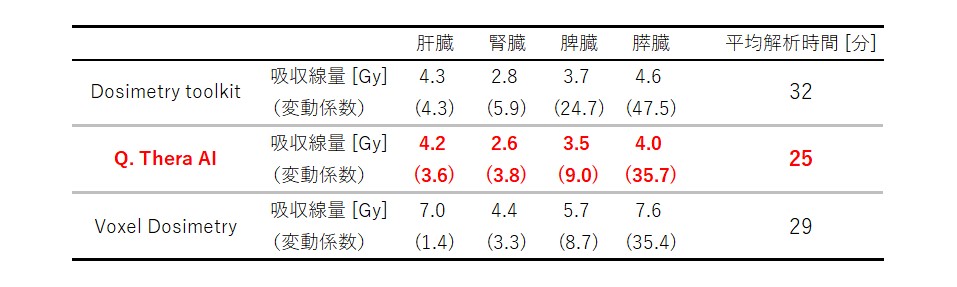
当院で使用している3種類のドシメトリーソフトウェアについて、臓器抽出、解析にかかる時間を比較しましたのでご紹介します。 実験では、6名の診療放射線技師(内、核医学専門技師4名)がQ.Thera AI、Dosimetry toolkitおよびVoxel dosimetryを用いて、3名の同一患者の177Lu DOTA-TATE治療における核医学画像から、内部被ばくの算出を行いました。 その結果、図2に示すように臓器抽出における操作者間のばらつきは、Q.Thera AIで非常に小さくなることが分かりました。 また、表2に算出された吸収線量と平均解析時間を示します。 Q.Thera AIを用いて解析を行った場合、腎臓における操作者間のばらつきは3.8%と少なく、かつ最も短い時間で解析を行えるという結果になりました。 臨床における患者の被ばく管理の観点から、Q.Thera AIは、臓器ごとの吸収線量を簡便に精度よく解析ができる優れたツールであると言えます。
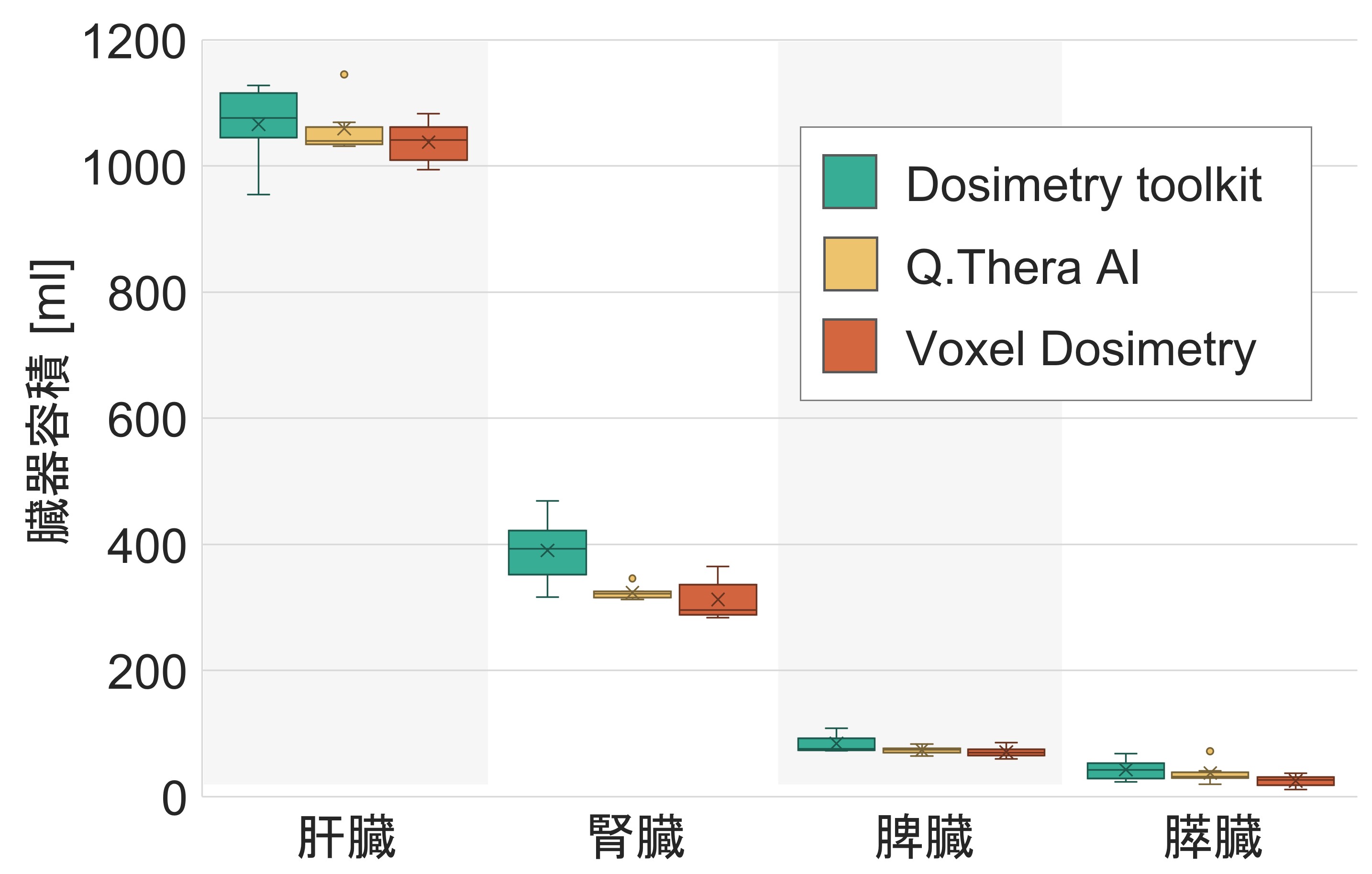
図2.ドシメトリーソフトウェアごとの臓器抽出容積の違い
表2. ドシメトリーソフトウェアごとの吸収線量と平均解析時間

Cookie Preferences | Privacy Policy | California Privacy Policy | Terms and Conditions | Security
Copyright and trademark statement: © 2026 GE HealthCare. GE is a trademark of General Electric Company. Used under trademark license.